LAVOISIER

Antoine-Laurent de Lavoisier (1743-1794), accompagné de sa femme sur le tableau, est souvent considéré comme le père de la chimie moderne.
Les expériences de Lavoisier
sur la combustion
Lavoisier n’a pas découvert
l’oxygène, mais en a élucidé le
rôle dans la combustion.
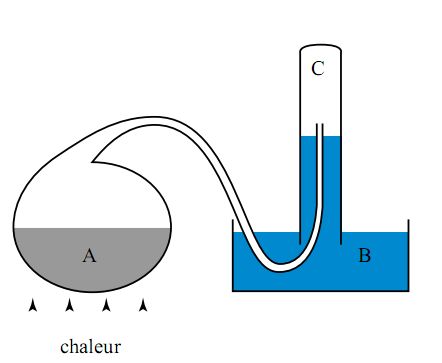 Dans un premier temps, Lavoisier chauffe de l’oxyde de
mercure (HgO) dans un ballon (A), en présence de charbon
de bois. L’oxyde, une poudre rougeâtre, se
transforme graduellement en mercure métallique et un gaz
est produit et recueilli en (C). Ce gaz est
caractérisé par Lavoisier, qui conclut
qu’il s’agit d’air fixe (gaz carbonique): il
est assez soluble dans l’eau, éteint une flamme,
asphyxie des petits animaux et précipite la chaux morte
(chaux éteinte). En langage moderne, la réaction
étudiée dans ce cas-ci est
Dans un premier temps, Lavoisier chauffe de l’oxyde de
mercure (HgO) dans un ballon (A), en présence de charbon
de bois. L’oxyde, une poudre rougeâtre, se
transforme graduellement en mercure métallique et un gaz
est produit et recueilli en (C). Ce gaz est
caractérisé par Lavoisier, qui conclut
qu’il s’agit d’air fixe (gaz carbonique): il
est assez soluble dans l’eau, éteint une flamme,
asphyxie des petits animaux et précipite la chaux morte
(chaux éteinte). En langage moderne, la réaction
étudiée dans ce cas-ci est
En un deuxième temps, il répète l’expérience, mais en omettant le charbon de bois. Le mercure retourne encore à l’état métallique, mais le gaz recueilli est radicalement différent : il est peu soluble dans l’eau, facilite la combustion et la respiration des animaux. Ce gaz semble être une forme “purifiée” d’air commun. C’est l’air déphlogistiqué de Priestley. La réaction étudiée est en fait:
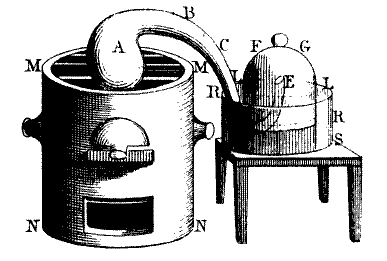
Manifestement, le charbon de bois se combine à cet air déphlogistiqué pour former de l’air fixe. Lavoisier procède à une troisième expérience, plus convaincante : il procède à un chauffage lent (sur une douzaine de jours) d’un ballon de mercure métallique (A), à l’aide du même appareil. Le mercure bout doucement, en présence de l’air initialement contenu dans le ballon. Or, il apparaît des grains rougeâtres d’oxyde de mercure (HgO) et le volume d’air du ballon diminue d’un sixième environ. Ceci se mesure à la hauteur de la colonne d’air C, étant donné que le bassin B est rempli d’eau. L’air restant ne peut entretenir la vie : Lavoisier l’appelle "mofette atmosphérique" mais on l’appelle bientôt azote, du grec "zôè" qui veut dire “vie”, précédé d’un ‘a’ privatif (pas de). Lavoisier recueille ensuite les particules d’oxyde de mercure, les chauffe vivement, comme lors de la deuxième expérience ci-dessus, recueille le gaz produit et constate qu’il correspond au volume d’air perdu lors de l’étape précédente. Il constate de plus que la masse du mercure métallique produit est inférieure à celle de l’oxyde de départ, masse attribuée à l’air déphlogistiqué produit par la réaction.
La conclusion la plus immédiate de cette dernière expérience est que la formation de l’oxyde de mercure résulte d’une combinaison avec l’air déphlogistiqué qui constitue une partie de l’air commun, et non d’une émission de phlogistique par le mercure métallique. En effet, la théorie du phlogistique ne peut expliquer pourquoi la réaction sature quand le volume de l’air a diminué d’environ 1/6, alors qu’il resterait amplement de mercure (et de phlogistique) pour lui permettre de continuer. Il est beaucoup plus simple de supposer que le mercure se combine avec l’air déphlogistiqué pour former l’oxyde (2Hg + O2 ¾® 2HgO), ce qui explique la saturation de la réaction, ainsi que l’augmentation de la masse de l’oxyde par rapport au mercure correspondant.
Dans ses expériences ultérieures, Lavoisier démontre que l’air déphlogistiqué est un constituant de nombeux acides et pour cette raison le renomme oxygène (du grec "gen" pour "générer" et "oxus" pour “vinaigre”). En fait, il croit que l’oxygène est un constituant obligé de tous les acides (ceci constitue l’une de ses erreurs).
Lavoisier publie en 1789 le Traité élémentaire de Chimie, dans lequel il décrit un système révolutionnaire de chimie. en plus du nouveau concept d'élément, il contient:
- un grand nombre de faits observés expérimentalement,
- son explications de ces "faits" et
- le nouveau système de nomenclature que Lavoisier jugeait essentiel.
La Théorie des quatre éléments est abandonnée: Tous les Airs distincts deviennent des gaz particuliers dont plusieurs sont des éléments. L'Eau devient un composé d'oxygène et d'hydrogène. La Terre est un ensemble de substances, surtout des composés. Le Feu devient deux éléments: Calorique et Lumière.
Les composés métalliques étudiés par les alchimistes deviennent dix-sept éléments distincts. Le mercure n'est plus qu'un élément métallique. Les mélanges de métaux deviennent des alliages.
La combustion est le processus de se combiner avec l'oxygène. Tous les acides contiennent de l'oxygène et un élément distinctif. Le soufre est un des six éléments non-métalliques acidifiables. Les sels sont des combinaisons d'acides soit avec des métaux, soit avec des bases de la Terre. Lavoisier croit que les alcalins se trouveront sous la forme de composés.
La fin de Lavoisier
Lavoisier ne fitt pas que de la recherche fondamentale, loin de là. En 1775 il fut nommé régisseur des poudres, avec comme mission d’améliorer la poudre à canon françcaise, l’une des moins efficaces en Europe à l’époque. Lavoisier en fit la meilleure d’Europe. Comme il faut bien vivre, Lavoisier acheta des parts dans la Ferme générale. Cette compagnie privée procédait à la collecte des impôts pour le compte du roi et prélevait naturellement son pourcentage. Elle disposait d’un mur entourant la ville de Paris (le mur des fermiers généraux) qui lui permettait de contrôler le flot des marchandises. Les fermiers généraux s’attirèrent naturellement l’hostilité de la population et ils furent exécutés pendant la Terreur. En 1794. Lavoisier périt donc sur la guillotine, ce qui fit dire à Lagrange, le célèbre mathématicien : “Il ne leur a fallu qu’un instant pour lui trancher la tête, mais une centaine d’années n’en produira peut-être pas une semblable.” Sa veuve, Marie-Anne Pierrette, épousa en 1804 le scientifique anglo-américain Sir Benjamin Thompson, comte de Rumford, dont elle se sépara en 1809.