 Acides, bases et sels
Acides, bases et selsLes composés qui, en solution aqueuse (du latin "aqua", eau), contiennent des ions sont classés en acides, bases ou sels.
Un acide est un composé qui, dans l'eau, libère des protons, c'est-à-dire des ions hydrogène, H +.
Remarque: Pour les puristes, notons qu'en fait l'ion H + n'est pas libre mais qu'il forme avec une molécule d'eau l'ion oxonium (ou hydronium) H3O +.
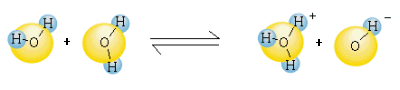
Une base est un composé qui, en solution aqueuse, forme des ions hydroxyles, OH -. Un sel est un composé qui libère dans l'eau des ions positifs provenant de la base et des ions négatifs provenant de l'acide.
Caractéristiques des acides :
Pendant des siècles, les acides étaient uniquement associés à des substances au goût aigre. Le vinaigre, dont l'appellation provient de "vin" et "aigre", contient de l'acide acétique. Cette acide est produit par la réaction entre l'alcool du vin et l'oxygène de l'air. Il est connu depuis 4000 ans et est resté pendant longtemps le seul acide industriel.
Caractéristiques des bases:
Remarque: Les Anglo-saxons incluent dans les bases des composés comme certains oxydes, qui réagissent avec les acides pour ne donner qu'un sel et de l'eau.
Note: Les bases sont connues depuis aussi longtemps que les acides. Il y a plus de 4000 ans, les Égyptiens en utilisaient dans leur procédé de momification et ce, avant de les employer dans la fabrication du verre.
Caractéristiques des sels:
Il faut absolument voir la nomenclature
Force des acides et des bases:
Dans une solution, plus la concentration d'ions H + est grande et plus la solution est acide; plus la concentration en ions OH - est grande et plus la solution est basique (ou alcaline). Les composés comme l'eau qui libèrent autant d'ions H + que d'ions OH - sont neutres.
| Indication de l'acidité et de l'alcalinité en terme de pH | |||
|
H + (mol/L) |
en termes d'exposants |
en pH |
|
| 1.0 |
10 0 |
|
0 |
| 0.1 |
10 -1 |
1 |
|
| 0.01 |
10 -2 |
2 |
|
| 0.001 |
10 -3 |
3 |
|
| 0.000 1 |
10 -4 |
4 |
|
| 0.000 01 |
10 -5 |
5 |
|
| 0.000 001 |
10 -6 |
6 |
|
| 0.000 000 1 |
10 -7 |
neutre |
7 |
| 0.000 000 01 |
10 -8 |
8 |
|
| 0.000 000 001 |
10 -9 |
9 |
|
| 0.000 000 000 1 |
10 -10 |
10 |
|
| 0.000 000 000 01 |
10 -11 |
11 |
|
| 0.000 000 000 001 |
10 -12 |
12 |
|
| 0.000 000 000 000 1 |
10 -13 |
13 |
|
| 0.000 000 000 000 01 |
10 -14 |
|
14 |
Comme on le constate d'après ce tableau, chaque fois que le pH diminue de 1, la quantité d'ions H + est 10 fois plus forte.
Note : en fait, le pH = - log [conc. en H + (en mole/L)].
| Tableau du pH de quelques produits de consommation | |
| Substance |
pH (approximatif>
|
|---|---|
| Acide d'accumulateur (H2SO4) |
0
|
| Acide chlorhydrique (HCl) Ã 0,1 M |
1,0
|
| Vinaigre (CH3COOH) |
2,2
|
| Citron |
2,2
|
| Boisson gazeuse, vin. bière |
3,0
|
| Pomme |
3,1
|
| Raisin |
3,1
|
| Orange |
3,5
|
| Cerise |
3,6
|
| Tomate |
4,2
|
| Banane |
4,6
|
| Café noir |
5,0
|
| Pain |
5,5
|
| Pomme de terre |
5,8
|
| Lait |
6,6
|
| Eau pure |
7,0
|
| Oeuf |
7,8
|
| Détergent au phosphate |
9,0
|
| Savon |
10,0
|
| Lait de magnésie |
10,5
|
| Ammoniaque domestique |
11,1
|
| Crème épilatoire |
12,0
|
| Nettoyeur pour le four |
13,0
|
| Hydroxyde de sodium (NaOH) à 0,1 M |
13,0
|
| pH normaux de quelques liquides du corps humain | |
|
Liquide
|
pH
|
| Bile |
de 7,4 à 8,0
|
| Larmes |
de 7,0 à 7,4
|
| Salive |
de 6,9 à 7,5
|
| Sang |
de 7,3 à 7,5
|
| Suc gastrique |
de 1 à 2
|
| Suc pancréatique |
de 7 à 8
|
| Sueur |
de 4,5 à 7,5
|
| Urine |
de 4,5 à 7,5
|
Cliquer pour avoir l'applet "Courbe de titrage".