 Liaisons entre atomes
Liaisons entre atomesL'étude de la configuration électronique des atomes nous montre que les atomes les plus stables, les gaz rares, ont un octet (8) d'électrons sur leur couche périphérique, sauf l'hélium qui, avec 2 électrons, a sa couche K saturée donc stable. C'est donc cet état de stabilité que les atomes vont chercher à acquérir en essayant de ressembler au gaz rare le plus proche et en s'unissant entre eux pour former des composés électriquement neutres.
Pour réaliser cet équilibre, ils peuvent soit perdre ou gagner des électrons sur leur dernière couche, soit partager des électrons avec d'autres atomes.
Liaisons ioniques :

Quand des atomes ou des groupements d'atomes perdent des électrons sur leur dernière couche, ils deviennent des ions chargés positivement ou cations tandis que des atomes gagnant un ou des électrons deviennent des ions négatifs ou anions.
Ex.: Pour ressembler à 10Ne, 11Na (2, 8, 1) perdra 1 e- pour donner l'ion Na+ et, pour ressembler à 18Ar, 17Cl (2, 8, 7) gagnera 1 e- pour donner l'ion Cl- . Ils s'attireront pour former des molécules de NaCl (on devrait plutôt dire des composés électrovalents dont l'unité de base est NaCl).
Note : Une "molécule" de NaCl n'existe pas au sens courant ; la liaison ionique s'applique au cristal, assemblage d'atomes qui se répète à l'infini, aussi bien qu'à un exemple de sa répétition désordonnée : le verre. La liaison ionique est à l'origine de la cohésion des céramiques, des roches, des verres, et évidemment des cristaux.
De telles liaisons peuvent aussi se former entre, par ex., un ion Ca ++ et deux ions OH - pour donner Ca(OH)2. Dans les cristaux, les forces électrostatiques de ces liens peuvent être assez facilement brisées par les molécules d'eau, ce qui explique que les composés électrovalents sont souvent hydrosolubles.
Voir tableau des ions principaux.
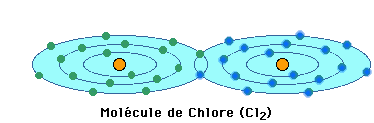 Quand des atomes se trouvent dans un milieu où,
pour ressembler aux gaz rares, tous veulent soit prendre, soit
donner des électrons, ils ne peuvent évidemment pas
former de liaisons électrovalentes. La solution dans ce
cas consiste à partager des électrons de leur
couche périphérique. Ainsi, dans l'exemple
ci-dessus, chaque atome de chlore partage un électron avec
son voisin pour former une molécule de Cl2. Il
en est ainsi pour tous les éléments formant des molécules
de gaz contenant deux atomes et appelées pour cette raison
diatomiques.De même, un atome
de 6C (2, 4) peut partager 4 de ses électrons
avec deux atomes de 8O (2, 6), qui partagent chacun 2
électrons avec C, pour former du CO2. Le fait
qu'il y ait peu d'attraction entre les molécules ainsi formées
explique que la plupart des composés covalents soient des
gaz ou des liquides. En pratique, on utilise souvent le système de LEWIS pour représenter
les liaisons covalentes.
Quand des atomes se trouvent dans un milieu où,
pour ressembler aux gaz rares, tous veulent soit prendre, soit
donner des électrons, ils ne peuvent évidemment pas
former de liaisons électrovalentes. La solution dans ce
cas consiste à partager des électrons de leur
couche périphérique. Ainsi, dans l'exemple
ci-dessus, chaque atome de chlore partage un électron avec
son voisin pour former une molécule de Cl2. Il
en est ainsi pour tous les éléments formant des molécules
de gaz contenant deux atomes et appelées pour cette raison
diatomiques.De même, un atome
de 6C (2, 4) peut partager 4 de ses électrons
avec deux atomes de 8O (2, 6), qui partagent chacun 2
électrons avec C, pour former du CO2. Le fait
qu'il y ait peu d'attraction entre les molécules ainsi formées
explique que la plupart des composés covalents soient des
gaz ou des liquides. En pratique, on utilise souvent le système de LEWIS pour représenter
les liaisons covalentes.
Pour accéder à un tableau des énergies d'ionisation, cliquez ici
Vous en saurez plus sur les liaisons entre les atomes en allant à la page Lewis et surtout au texte traitant de l'électronégativité.