 Atome
du grec "a-tomos", "in-divisible"
Atome
du grec "a-tomos", "in-divisible"On
définit généralement l'atome comme étant la plus petite
partie d'un élément
possédant les propriétés chimiques de cet élément.
Cliquez pour avoir un aperçu des différents modèles qui
se sont succédé de Leucippe de Milet à nos jours.
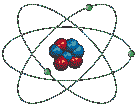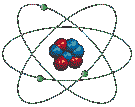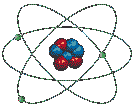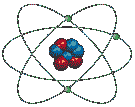
Le modèle suivant, tout en ne représentant pas vraiment l'atome réel, nous permet de comprendre les grandes lignes de sa structure.
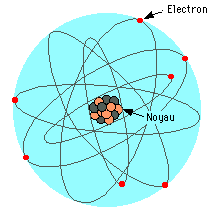 L'atome de n'importe quel élément
comprend deux parties :
L'atome de n'importe quel élément
comprend deux parties :
a. particules positives, les protons (symbole "p")
b. particules neutres, les neutrons (symbole "n").
Note
: Protons et neutrons ont la même masse de 1 unité atomique. La
masse
d'un proton est égale à environ : 1,672 x 10 -24
g.
Alors que l'électron reste une particule élémentaire (sans structure connue),
on sait (voir Histoire de l'atome) que ce n'est pas le
cas des nucléons: proton et neutron (durée de demi-vie de 615 secondes hors du
noyau...).
Note : La masse d'un électron est environ 1840 fois plus faible que celle d'un proton. Autrement dit, elle est négligeable.
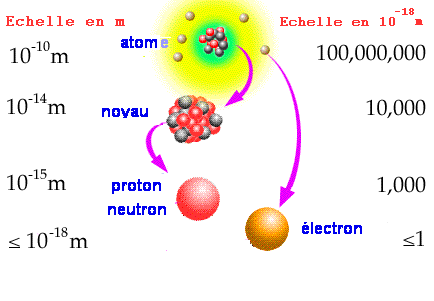
Comme on le voit ci-dessus, le diamètre de l'atome est environ 10 000 (mais cela peut aller jusqu'à 100 000) fois plus grand que celui de son noyau, ce qui implique que la plus grande partie de l'atome est constituée de VIDE ! Ainsi, si on représentait par une orange le noyau d'un atome de zinc, ses électrons périphériques tourneraient à 5 km de son centre. Cette notion est importante pour comprendre l'énorme masse volumique de certaines étoiles.
Masse
et numéro atomique: La masse atomique correspond
à la somme des protons et des neutrons, elle s'inscrit en haut et à
gauche du symbole. Ex. : 12C.
Attention : Si la masse d'un atome est un nombre entier, la masse relative indiquée dans le tableau périodique est une moyenne des masses des différents atomes d'un même élément. Elle varie donc selon
les isotopes de l'élément.
Le numéro atomique
correspond au nombre des protons (et des électrons de l'atome neutre), il
s'inscrit en bas et à gauche du symbole. Ex. : 6C. La différence entre la masse et le numéro
atomiques donne donc le nombre des neutrons.
| Numéro atomique | Symbole | K | L | M | N |
| 1 |
H | 1 | |||
| 2 |
He | 2 | |||
| 3 |
Li | 2 |
1 | ||
| 4 |
Be | 2 |
2 | ||
| 5 |
B | 2 |
3 | ||
| 6 |
C | 2 |
4 | ||
| 7 |
N | 2 |
5 | ||
| 8 |
O | 2 |
6 | ||
| 9 |
F | 2 |
7 | ||
| 10 |
Ne | 2 |
8 | ||
| 11 |
Na | 2 |
8 | 1 | |
| 12 |
Mg | 2 |
8 | 2 | |
| 13 |
Al | 2 |
8 | 3 | |
| 14 |
Si | 2 |
8 | 4 | |
| 15 |
P | 2 |
8 | 5 | |
| 16 |
S | 2 |
8 | 6 | |
| 17 |
Cl | 2 |
8 | 7 | |
| 18 |
Ar | 2 |
8 | 8 | |
| 19 |
K | 2 |
8 | 8 |
1 |
|
20 | Ca |
2 | 8 |
8 | 2 |
Note: La lettre K aurait pour origine un terme allemand, "das Kern", qui signifie "le noyau". Les électrons de la couche K sont les électrons les plus proches du noyau. Ce sont les électrons du "coeur". Les spectroscopistes utilisaient ces termes. Pour la lettre L, il suffit de prendre la lettre suivante de l'alphabet !
LE TABLEAU PÉRIODIQUE : Un savant russe, Mendéléev, construisit le tableau périodique en se basant sur les propriétés des éléments. Il a placé dans les mêmes colonnes les éléments qui avaient des comportements semblables.