 Histoire de l'atome
Histoire de l'atomeC'est dans la Grèce antique qu'est née, il y a 25 siècles, l'idée de l'atome.
Le mot "atome" vient du grec "a-tomos" et signifie "insécable". Cette notion fut émise par Leucippe de Milet en 420 avant J.C.
 |
Son disciple, Démocrite d'Abdera (env. 460-370 avant J.C) , expliquait que la matière était constituée de corpuscules en perpétuel mouvement et dotés de qualités idéales. |
|
Mais une deuxième conception de la matière
fut aussi défendue, dès le sixième
siècle avant J.C. (modèle continu de
Thalès, Anaximène, Aristote, etc). |
 |
 |
 La "boule de billard" (1803) |
Puis, le concept d'atome fut réactualisé
en Angleterre par John Dalton
(1766- 1844). Il était tellement brillant qu'il devint enseignant en Angleterre à l'âge de 12 ans.
|
 |
 |
Ce ne fut qu'en 1897 que l'anglais J.J. Thomson (1856-1940) eut les moyens expérimentaux suffisants pour sonder la matière. Il constata alors que les atomes émettaient parfois de petites particules de charges électriques négatives (des électrons). L'atome étant globalement électriquement neutre, on dut admettre qu'il contenait aussi à l'intérieur une charge électrique positive. Cela donna naissance au fameux "plum pudding". |
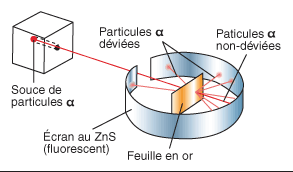
Le modèle atomique évolua lorsqu'en 1911 Rutherford (1871-1937), élève de Thomson, et ses étudiants, Geiger et Marsden, réalisèrent une expérience cruciale. Ils bombardèrent des feuilles d'or par des particules alpha (ce sont des particules de charge électrique positive double, issues de la radioactivité naturelle).
 |
 |
Ils constatèrent alors que ces "particules-projectiles" alpha étaient rarement déviées par les "atomes cibles" des feuilles d'or. En effet, on observait généralement une légère diffusion due aux électrons. Parfois, mais très rarement, on observait néanmoins une forte déviation d'une de ces particules alpha. |
Cela signifiait en fait que l'atome était formé d'une grande région diffuse peuplée de petits électrons et d'une petite partie centrale et concentrée de charge électrique positive (le noyau).
Après les travaux de Rutherford qui introduisit le
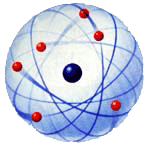
concept de nuage électronique, le Danois Bohr (1885-1962) inventa un modèle
"planétaire".
Comme chez Rutherford, le noyau fut situé
géométriquement au centre, alors que les
électrons gravitaient à la périphérie
(les électrons jouaient le rôle des planètes
gravitant autour du noyau qui correspondait au soleil).

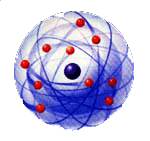
Par contre, Bohr imposa arbitrairement des orbites électroniques bien précises, notamment en ce qui concerne l'énergie de chaque groupe d'électrons. Le modèle de l'atome quantique de Bohr porte parfois aussi le nom de modèle en couches électroniques.
Le modèle de l'atome de Niels Bohr était un modèle à la
frontière de deux âges: l'âge classique pré-quantique et le monde quantique.
Mais il expliquait déjà le mécanisme de l'émission de lumière par un
atome.
![]()
 |
En 1932, Chadwick (1891-1974) découvrit le neutron qui est une particule semblable au proton mais avec une différence fondamentale: le neutron ne possède pas de charge électrique (il est électriquement neutre, d'où son nom!). On réalisa alors que le noyau atomique était composé de protons et de neutrons. Les neutrons sont, entre autre, utiles pour la stabilité du noyau. En effet, ils sont soumis à la force d'interaction forte (qui agit entre tous les nucléons; c'est-à-dire entre proton-proton, neutron-neutron et proton-neutron). |
Ainsi, dans le noyau, la contribution de la force de répulsion électrique (agissant uniquement entre les protons) est nettement inférieure à celle des interactions fortes (agissant entre tous les nucléons).
Même si le modèle de Bohr expliquait adéquatement diverses notions, plusieurs problèmes tracassaient les chimistes et les physiciens.:
Il était évident que le modèle de Bohr était déficient!
En 1924, un physicien français, Louis de Broglie suggéra que, comme la lumière, les électrons pouvaient se comporter à la fois comme particules et comme ondes. L'hypothèse de de Broglie fut bientôt confirmée lors d'expériences qui démontraient que des faisceaux d'électrons pouvaient être diffractés ou courbés lorsqu'ils passaient à travers une fente, de la même façon que la lumière le ferait. Ainsi, les ondes produites par un électron confiné sur son orbite autour du noyau créent une onde stationnaire de longueur d'onde, d'énergie et de fréquence spécifiques un peu comme l'onde stationnaire produite quand on pince une corde de guitare.
Une autre question suivit rapidement l'idée exprimée par de Broglie. Si un électron voyageait comme une onde, pouvait-on localiser la position précise de cet électron dans l'onde? Un physicien allemand, Werner Heisenberg, répondit non à cette question en exprimant ce qu'il a appelé le principe d'incertitude.:
On ne peut connaître avec précision à la fois la vitesse et la position d'un électron d'un atome. C'est pourquoi, dit Heiseberg, nous ne devrions pas faire comme si les électrons se déplaçaient autour du noyau sur des orbites circulaires bien définies!
De là, ayant à l'esprit l'hypothèse de de Broglie et le principe d'incertitude de Heisenberg, un physicien autrichien, Erwin Schrödinger, établit en 1926 une série d'équations et de fonctions d'onde pour les électrons. Selon Shrödinger, les électrons, confinés sur leurs orbites, déclencheraient des ondes stationnaires et on ne peut décrire que la possibilité de leur localisation. La distribution de ces possibilités forme autour du noyau des régions spaciales appelées orbitales. Les orbitales peuvent être décrites comme des nuages électroniques. La partie la plus dense du nuage indique l'endroit où la probabilité de trouver l'électron est la plus grande et, inversément, la partie la moins dense indique l'endroit oû il y a le moins de chance de trouver l'électron.
On peut désigner les électrons en utilisant les sous-couches et les orbitales et en utilisant les quatre NOMBRES QUANTIQUES:
Nombre quantique principal, n
n est toujours un nombre entier positif et il décrit la GRANDEUR de l'orbitale. Comme la distance entre l'électron et le noyau est directement proportionnelle à l'énergie de l'électron (comme Bohr l'avait décrit dans son modèle), le nombre quantique principal est aussi une mesure de l'orbitale .
Nombre quantique secondaire ou azimutal, lIl décrit la FORME de l'orbitale.
le nombre quantique magnétique, ml, décrit l'ORIENTATION de l'orbite dans l'espace.
Le nombre quantique de spin
, ms, exprime le sens de ROTATION de l'électron sur lui-même et a comme valeur +1/2 ou -1/2, valeurs représentées conventionnellement par 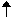 et
et 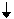 . Si deux électrons (le maximum permis) sont sur n'importe quelle orbite ils seront toujours de spins opposés.
. Si deux électrons (le maximum permis) sont sur n'importe quelle orbite ils seront toujours de spins opposés.
Pour le nombre entier positif n, indiquant le niveau d'énergie, on a les orbitales ci-dessous:
l = 0, orbitale s (peut contenir jusqu'à 2 e-) l = 1, orbitale p (peut contenir jusqu'à 6 e-)
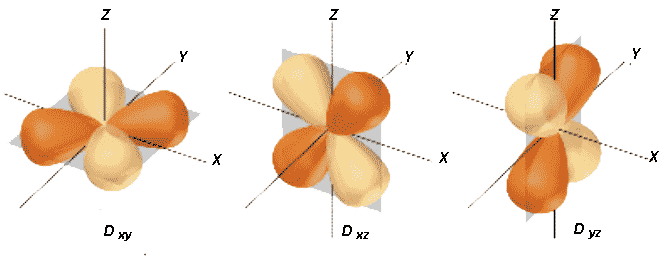 | 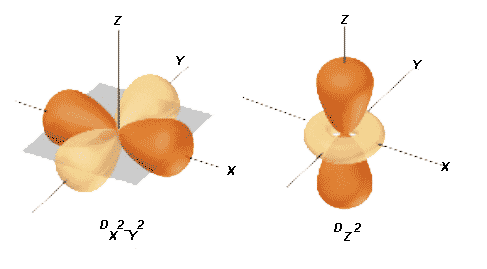 |
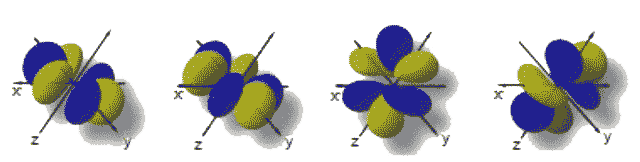 |
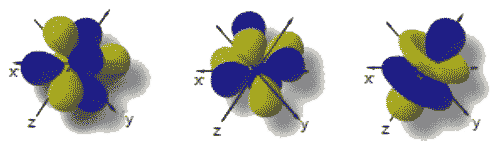 |
En résumé, on aura alors la correspondance suivante entre les désignations des orbitales (nombre quantique l) et les différentes orientations possibles de celles ci (nombre quantique m):
| Orbitale | Valeurs de l |
Orientations possibles |
Valeurs de m |
Désignation des orbitales obtenues |
| s | 0 | 1 | 0 | orbitale s |
| p | 1 | 3 | -1; 0; +1 | orbitale px; orbitale py; orbitale pz |
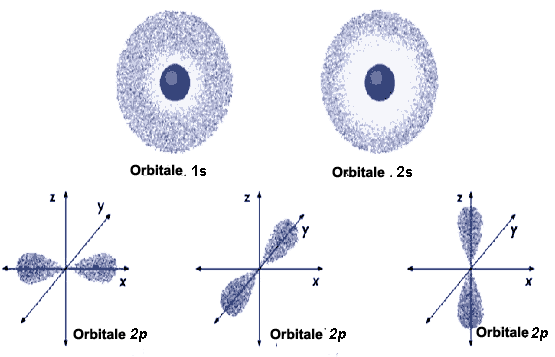
| d | 2 | 5 | -2; -1; 0; +1; +2 | orbitale dxy; orbitale dxz; orbitale dyz; orbitale dx2 - y2; orbitale dz2. |
| f | 3 | 7 | -3; -2; -1; 0; +1; +2; +3 | Ne portent pas de désignation particulière. |
Cette règle de Klechkowski est un moyen mnémotechnique pour se rappeler l'ordre de remplissage successif des orbitales par les électrons.
Comme nous l'avons vu lors de la description de l'atome, les couches électroniques, de K à Q, peuvent contenir un certain MAXIMUM d'électrons. Malheureusement pour notre facilité et pour des raisons qui dépassent la portée de ces pages, les électrons ne remplissent pas toujours successivement toutes les couches.
Ils remplissent plutôt des sous-couches appelées orbitales et cela dans une succession bien précise, comme l'indiquent les flèches sur la figure ci-dessous.
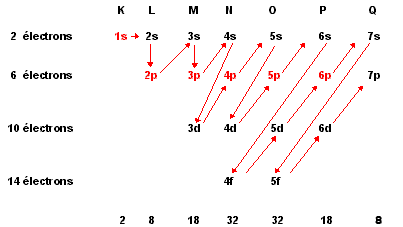
Il y a certaines exceptions à cette règle:
Première exception, le chrome (Z = 24), le schéma prévoit pour Cr la configuration électronique [Ar]3d44s2 mais les expériences donnent comme résultat [Ar]3d54s1.
L'exception suivante est celle du cuivre (Z = 29) avec une configuration électronique prévue de [Ar]3d94s2 mais que l'expérience révèle être en réalité [Ar]3d104s1.
La raison pour ces exceptions et pour d'autres ne sont pas complètement comprises, mais il senble la sous-couche à demi remplie 3d dans le cas du chrome ou la sous-couche complètement remplie 3d subshell dans le cas du cuivre confère une stabilité particulière à la configuration électronique observée. Il n'y a pas lieu ici de creuser plus ces exceptions. Rappelons-nous que la règle de Klechkowski prédit la plupart du temps la configuration électronique correcte et que l'énergie de cette configuration électronique prévue est très proche de l'énergie de base.
Note : Les physiciens modernes ont mis au point une théorie appelée le Modèle Standard, qui tente de décrire toute la matière et toutes les forces de l'univers (sauf la gravité). Son élégance réside dans sa capacité à justifier l'existence de centaines de particules et d'interactions complexes avec un minimum de constituants et d'interactions élémentaires.
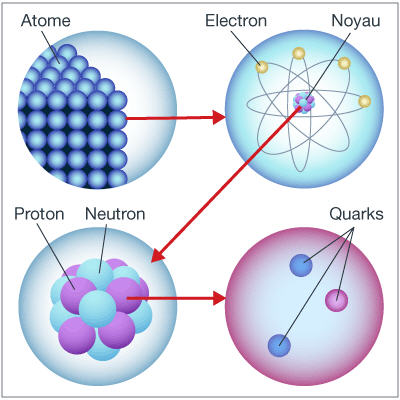
Il y a deux sortes de particules élémentaires :
Ce qui rend le Modèle Standard si "simple" c'est qu'il explique que toutes les particules observées peuvent être obtenues à partir de :
|
Source : C'est pas sorcier |
Pour chaque particule de matière, il y a une particule correspondante d'antimatière, appelée antiparticule.
Quand une particule d'antimatière rencontre une particule de matière, elles se détruisent avec une grande libération d'énergie.
Adressez remarques ou commentaires à
©2003-2011 I. Noels
(source partielle: dynamicscience.com.au