 |
La nomenclature inorganique |
 |
La nomenclature inorganique |
Les premiers chimistes utilisaient les symboles du soleil et des planètes pour identifier les éléments métalliques qu'ils connaissaient.
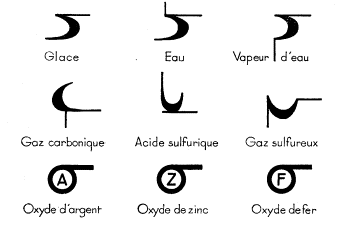 |
||
 |
 |
 |
| Cuivre ou Vénus | Fer ou Mars | Or ou Soleil |
Cela devint évidemment un problème quand plus
d'éléments furent découverts et qu'ils
tombèrent à cours de planètes.
John Dalton
(6 septembre 1766 – 27 juillet 1844) developpa au
début du 19ème siècle une nouvelle série de
symboles pour améliorer la communication entre
chimistes.
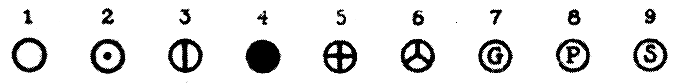 |
||||||||
| O |
H |
N |
C |
S |
P |
Au |
Pt |
Ag |
 |
||||||||
| Hg | Cu | Fe | Ni | Sn | Pb | Zn | Bi | Sb |
 |
||||||||
| As | Co | Mn | U | W | Ti | Ce | K | Na |
 |
||||||||
| Ca |
Mg |
Ba |
Sr |
Al |
Si |
Y |
Be |
Zr |
Plus tard, Berzélius révisa les symboles de Dalton en les remplaçant, comme à présent, par des lettres au lieu de dessins. Il représenta les éléments par leur première lettre (en majuscule) ou en ajoutant à celle-ci une deuxième lettre (en minuscule).
IntroductionLes éléments (atomes) peuvent être classés en 2 grandes catégories:
Ne pas confondre les composés binaires, qui ne contiennent que 2 sortes d'atomes, mais peuvent avoir plus de 2 atomes et les molécules diatomiques, qui ne contiennent, elles, qu'un total de 2 atomes.
L'Union internationale pour la chimie pure et appliquée (UICPA) a établi une manière universelle de nommer les composés de façon à ce que tous les chimistes puissent se comprendre entre eux.
Cette nomenclature moderne est parfois un peu lourde, mais elle offre l'avantage de réduire considérablement l'effet de mémoire.
1. a) Les oxydes
métalliques
|
|
Oxyde + nom de métal (+ éventuellement l'état d'oxydation, E.O.) |
| Na2O | Oxyde de sodium |
| Fe2O3 | Oxyde de fer(III) |
Les oxydes métalliques sont donc des composés chimiques
constitués d'un métal (Mx) et
d'oxygène (Oy). Certains sont connus sous un
nom usuel comme "chaux vive" pour CaO.
Le symbole du métal est suivi, si nécessaire, de
l'état d'oxydation comme dans: oxyde de cuivre (I) pour Cu2O.
Il est important de connaître le nom des principaux ions
ayant plusieurs charges possibles, ex. Fe ++, ion
ferreux et Fe +++, ion ferrique.
Il faut connaître les ions les plus courants de la
liste suivante.
1. b) Les oxydes
non-métalliques
|
|
Préfixe- oxyde du "nom du non-métal" |
|
|
Sesquioxyde d'azote |
| CO2 | Dioxyde de carbone |
Les oxydes non-métalliques sont donc des composés
chimiques constitués d'un non-métal (Xa) et
d'oxygène (Ob)
Le préfixe indique le rapport dans la formule entre le
nombre des atomes d'oxygène et celui des atomes de
non-métal, soit b/a, comme
l'indique le tableau ci-dessous.
| Préfixe b/a | |
| 1/2 | hémi |
| 1 | mono |
| 3/2 | sesqui |
| 2 | di |
| 5/2 | hémipent |
| 3 | tri |
| 4 | tetra |
| 5 | penta |
| 6 | hexa |
| 7 | hepta |
| 8 | octa |
| 9 | nona |
| 10 | déca |
2. Remarque sur l'acido-basicité des oxydes
Le caractère basique de l'oxyde va de pair avec son caractère ionique, le caractère acide avec son caractère covalent.
Un oxyde ionique est basique, car il contient l'ion O2- qui est hydrolysé en OH-
Les oxydes covalents, et plus particulièrement les oxydes moléculaires, sont généralement de type acide : c'est-à-dire que le pH de la solution devient acide lorsqu'ils sont dissous dans l'eau, ou alors qu'ils sont solubles en milieu basique :
M2O + H2O  2MO-(aq)
+ 2H+(aq)
2MO-(aq)
+ 2H+(aq)
En reportant dans le tableau périodique pour chaque élément le comportement de l'oxyde, on observe que les oxydes basiques correspondent aux combinaisons de l'oxygène avec les métaux peu électronégatifs, c'est-à-dire des oxydes ioniques. Au contraire, les oxydes acides résultent de la formation de liaisons covalentes avec les non-métaux. Les oxydes amphotères se situent à la frontière des deux groupes.
 |
Li2O | BeO | B2O3 | CO2 | N2O5 | OF2 | |
| Na2O | MgO | Al2O3 | SiO2 | P4O10 | SO3 | Cl2O7 | |
| K2O | CaO | Ga2O3 | GeO2 | As2O5 | SeO3 | Br2O | |
| Rb2O | SrO | In2O3 | SnO2 | Sb2O5 | TeO3 | I2O5 | |
| Cs2O | BaO | Tl2O3 | PbO2 | Bi2O5 | |||
| oxydes basiques oxydes amphotères oxydes acides | |||||||
 |
|||||||
3. Les hydroxydes ou bases
|
|
hydroxyde de "nom du métal" (+ éventuellement l'E.O.) |
| Al(OH)3 | hydroxyde d'azote |
| Fe(OH)3 | hydroxyde de fer(III) |
Un hydroxyde, c'est donc un ion métallique (M x+) lié à
x groupe(s) (OH -).
En plus de leur nom scientifique, certains hydroxydes ont un
nom usuel.
| Hydroxydes | Noms usuels | |
| NaOH | Hydroxyde de sodium | soude (caustique) |
| KOH | Hydroxyde de potassium | potasse (caustique) |
| Ca(OH)2 | Hydroxyde de calcium | chaux éteinte |
Remarque: l'ammoniac (NH3) est une base faible mais l'hydroxyde d'ammoniac, NH4OH, n'existe pas: en réalité, c'est une solution aqueuse d'ammoniac, appelée communément ammoniaque, contenant surtout NH3 dissous et très peu de ions NH4+ et OH -.
4. Les hydracides ou acides binaires (liste des 8 acides)
| HX | "nom de x"
-ure d'hydrogène |
ou | Acide "nom de x"-hydrique |
| HCl | chlorure d'hydrogène | ou | acide chlorhydrique |
| HF | fluorure d'hydrogène | ou | acide fluorhydrique |
| HBr | bromure d'hydrogène | ou | acide bromhydrique |
| HI | iodure d'hydrogène | ou | acide iodhydrique |
| HCN | cyanure d'hydrogène | ou | acide cyanhydrique |
| H2S | sulfure d'hydrogène | ou | acide sulfhydrique |
| H2Se | sélénure d'hydrogène | ou | acide sélénhydrique |
| H2Te | tellure d'hydrogène | ou | acide tellurhydrique |
En général, on utilise l'expression acide "nom de x"-hydrique quand il s'agit d'une solution aqueuse et non de la forme gazeuse.
5. Les oxacides ou acides ternaires
| HXO | "nom de x"-ite d'hydrogène | ou | acide | "nom de x" -eux |
| "nom de x" -ate d'hydrogène | "nom de x" -ique |
| Quelques exemples | |||
| HClO | hypochlorite d'hydrogène | ou | acide hypochloreux |
| HClO2 | chlorite d'hydrogène | ou | acide chloreux |
| HClO3 | chlorate d'hydrogène | ou | acide chlorique |
| HClO4 | perchlorate d'hydrogène | ou | acide perchlorique |
| H2SO3 | sulfite d'hydrogène | ou | acide sulfureux |
| H2SO4 | sulfate d'hydrogène | ou | acide sulfurique |
| HNO2 | nitrite d'hydrogène | ou | acide nitreux |
| HNO3 | nitrate d'hydrogène | ou | acide nitrique |
| H3PO3 | phosphite d'hydrogène | ou | acide phosphoreux |
| H3PO4 | phosphate d'hydrogène | ou | acide phosphorique |
| H2CO3 | carbonate d'hydrogène | ou | acide carbonique |
| HBrO | hypobromite d'hydrogène | ou | acide hypobromeux |
| HBrO2 | bromite d'hydrogène | ou | acide bromeux |
| HBrO3 | bromate d'hydrogène | ou | acide bromique |
| HBrO4 | perbromate d'hydrogène | ou | acide perbromique |
| H3BO3 | borate d'hydrogène | ou | acide borique |
| H2CrO4 | chromate d'hydrogène | ou | acide chromique |
| H2Cr2O7 | dichromate d'hydrogène | ou | acide dichromique |
6. Les sels binaires ou sels d'hydracides
| MX | nom de X-ure (+ éventuellement l'E.O.) |
| NaCl | chlorure de sodium (sel de cuisine) |
| FeS | sulfure de fer (II) |
| NH4CN | cyanure d'ammonium |
| Fe2S3 | sulfure de fer (III) |
| Liste des principaux ions M+ et X- | |||
| Ion M+ | Ion X- | ||
| Al+++ | aluminium | H - | hydrure |
| Ag+ | argent | F - | fluorure |
| Ba++ | baryum | Cl - | chlorure |
| Ca++ | calcium | Br - | bromure |
| Cd++ | cadmium | I - | iodure |
| Co++ | cobalt (II) | S- - | sulfure |
| Cr+++ | chrome (III) | Se- - | sélénure |
| Cu+ | cuivre (I) | N- - - | nitrure |
| Cu++ | cuivre (II) | CN- - | cyanure |
| Fe++ | fer (II) | CH3COO- | acétate |
| Fe+++ | fer (III) | ClO3- | chlorate |
| K+ | potassium | ClO2- | chlorite |
| Mg++ | magnésium | ClO- | hypochlorite |
| Mn++ | manganèse (II) | ClO4- | perchlorate |
| Na+ | sodium | MnO4- | permanganate |
| NH4+ | ammonium | SCN- | thiocyanate |
| Pb++ | plomb (II) | CrO4-2 | chromate |
| Sn++ | étain (II) | Cr2O7-2 | dichromate |
| Sn++++ | étain (IV) | C2O4-2 | oxalate |
| Zn++ | zinc | SO3-2 | sulfite |
7. Les sels ternaires ou sels d'oxacides
| MXO | nom de X-ite + nom du métal | + éventuellement l'E.O. |
| nom de X-ate + nom du métal |
| Exemples | |
| K2SO3 | sulfite de potassium |
| Fe2SO4 | sulfate de fer (II) |
| CaPO3 | phosphite de calcium |
| Ca3(PO4)2 | phosphate de calcium |
| Fe(NO2)3 | nitrite de fer (III) |
| Fe(NO2)2 | nitrite de fer (II) |
| Fe(NO3)3 | nitrate de fer (III) |
| Fe(NO3)2 | nitrate de fer (II) |
8. Attention aux ions HXO !!! -
| MHXO | (di)hydrogéno nom de X-ite + nom du métal |
| (di)hydrogéno nom de X-ate + nom du métal | |
| NaHCO3 | hydrogénocarbonate de sodium |
| NaHSO3 | hydrogénosulfite de sodium |
| NaHSO4 | hydrogénosulfate de sodium |
| NaH2PO4 | dihydrogénophosphate de sodium |
| (NH4)2HPO4 | hydrogénophosphate d'ammonium |