 |
8x1/8 + 1 = 2 ions
STRUCTURE
DES MÉTAUX ET ALLIAGES
I – DÉFINITION
1.1
– Métal pur :
Un métal pur est un métal exempt de toute impureté c’est-à-dire contenant une pureté de 100% d’une seule espèce. Cela n’existe pas mais il peut atteindre une pureté de 99,9% pour le nickel, 99,99% pour le cuivre et 99,998% pour l’aluminium.
1.2
– Alliage :
Un alliage st un métal pur dans lequel on a introduit volontairement un ou plusieurs éléments d ‘addition. Il peut être binaire, ternaire ou quaternaire selon qu’il renferme deux, trois ou quatre éléments d’addition.
II – STRUCTURE
DES MÉTAUX ET ALLIAGES
L’observation des métaux et alliages montre que ceux-ci ont une organisation interne appelée structure. L’utilisation de certaines méthodes d’investigation nous permet de connaître les détails de la structure. Suivant le mode d’observation, on peut distinguer :
la structure macrographique ou macrostructure
la structure micrographique ou microstructure
la structure cristalline
2.1 – Structure
macrographique
L’examen macrographique utilise l’œil ou la loupe et il met généralement en exergue :
- la grosseur et la forme des grains
- les traitements mécaniques tels que laminage et forgeage
- la structure des dendrites
- la répartition des inclusions ou des cavités
La macrographie consiste à faire un polissage qui comporte un dégrossissage à la lime ou à la meule, suivi d’un finissage et d’une attaque à l’aide de réactifs.
En plus de la macrographie, il existe la macrofractologie qui consiste à faire l’analyse morphologique des pièces à partir de leurs cassures en vue de déterminer la cause de celles-ci.
2.2 – Structure micrographique
La micrographie a pour objectif principal de mettre en évidence la structure de l’échantillon sous forme de grains c’est-à-dire de déterminer les constituants de l’alliage. Elle permet aussi de contrôler les traitements chimiques ou mécaniques subis par l'alliage.
La préparation de l’échantillon après prélèvement comporte généralement trois phases :
le meulage : Il a pour but d’obtenir une surface bien dressée
le dégrossissage : Il permet d’obtenir un état de poli presque parfait de la surface de l’échantillon obtenue par meulage
le finissage : L’échantillon parfaitement poli est abondamment lavé pour éliminer toute trace d’alumine dont la présence risquerait de compliquer l’interprétation. Il se fait à l’aide d’une meule de feutre
2.3
– Structure cristalline
L’utilisation des rayons X ou g, qui ont la possibilité de pénétrer dans des métaux et même de les traverser sous une épaisseur de plusieurs centimètres, a permis d’établir que les grains sont formés de matières cristallisées appelées ions. Ceux-ci sont régulièrement disposés sous forme d’un réseau cristallin.
2.3.1
– Structure cristalline des métaux purs
Les
métaux sont des « solides cristallisés » constitués de mailles élémentaires
qui des groupements ordonnés d’atomes. C'est la répétition de ces mailles dans
les trois directions qui compose la matière. La plupart des métaux purs cristallise
dans l’un des trois systèmes suivants.
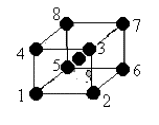
1 - Système cubique centré
La maille du réseau est cubique. Les atomes sont disposés à chaque sommet du cube et au centre. En réalise, chaque ion occupant un sommet appartient à huit cubes si bien que le nombre d’ions par maille est égal à deux.

8x1/8 + 1 = 2 ions
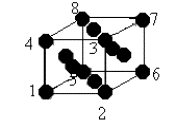
2
– Système cubique à faces centrées
Les atomes sont disposés aux sommets du cube et au centre de chaque face. Chaque ion d’un sommet appartient à huit cubes et chaque ion d’une face appartient à deux cubes. C’est le cas du ferg, de l’aluminium, du cuivre, etc.
3
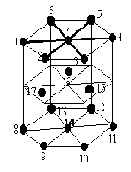
– Systeme hexagonal compact
La maille du reseau est un prisme à base hexagonale. Les atomes sont disposés à chaque sommet et au centre de chaque base ainsi qu’à trois points regulierement disposàs sur la base mediane.
Chaque ion d’un sommet appartient à six hexagones et chaque ion d’une base appartient à deux hexagones.
2.3.2
– Structure cristalline des alliages
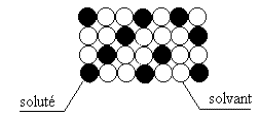
Une solution solide comporte au moins deux métaux. Celui dont le titre est le plus élevé est appelé, par convention, solvant et celui dont le titre est le plus faible est le soluté. Il existe deux types de solutions solides.
1 – Solution solide de substitution
Les solutions solides de substitution sont obtenues par remplacement d’une partie des atomes du solvant par les atomes du soluté. C’est le cas des combinaisons chimiquement définies (Fe3C, Cu2Mg, etc.)
 |
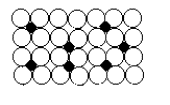
Le faible diamètre de l’ion du soluté vient s’insérer dans les interstices du
réseau atomique. C’est le cas du carbone dans le fer
gama.