
DIAGRAMMES DE SOLIDIFICATION DES ALLIAGES BINAIRES
Le diagramme de solidification est un ensemble de courbes donnant les températures de début et de fin de solidification de la totalité des alliages possibles.
I – PRINCIPE DE CONSTRUCTION DES DIAGRAMMES
Soit l’ensemble des alliages formés de deux métaux A et B et dont la composition varie de façon continue de 0% de A et 100% de B à 100% de A et 0% de B.

|
L’ensemble des liquidus et des solidus forme le DIAGRAMME DE SOLIDIFICATION des alliages A et B.
Tout point du diagramme correspond à un alliage dont la composition est donnée par la projection orthogonale du point sur l’axe des abscisses.
Tout point au dessus du liquidus correspond à un alliage entièrement liquide.
Tout point en dessous du solidus correspond à un alliage entièrement solide.
Tout point compris entre le liquidus et le solidus correspond à un alliage en cours de solidification c’est-à-dire en partie liquide et en partie solide.
II – CLASSIFICATION DES ALLIAGES BINAIRES
A l’état solide, les alliages binaires peuvent être classés en trois types d’après le nombre de solutions solides. Celles-ci sont mises en évidence par le solidus du diagramme de solidification.
2.1 – Alliages formant à froid une solution solide unique
C’est le cas des alliages Cu-Ni. Ces deux métaux sont miscibles à froid en toutes proportions. Toutes les courbes d’analyse thermique de la solidification de ces alliages présentent une anomalie simple.

|
Interprétation
du diagramme
1.
Etat physique de l’alliage
Soient les points Q, P, R représentant le même alliage à 45%Ni (55%Cu)
A 1400 oC , le point Q est entièrement liquide.
A 1250 oC , le point P est liquide-solide
A 1100 oC , le point R est entièrement solide
2. Alliages en cours de solidification
A l’aide de deux règles d’utilisation fondamentales, on peut trouver :
· La composition des phases liquide et solide en équilibre, à une température q, d’un alliage en cours de solidification.
· La masse des phases liquide et solide.
3. Règle de l’horizontale
A une température q, les compositions des phases liquide et solide
sont données respectivement par les abscisses des points d’intersection
de l’horizontale à la température q avec le liquidus et le solidus
(voir diagramme ci-dessus)
Exemple d’application : Déterminer la composition des phases liquide et solide à la température de
1250 oC
4. Règle des segments inverses
Pour un alliage en cours de solidification, dont le point figuratif
est P, à la température q(voir diagramme ci-dessus), le pourcentage
de liquide est PS/LS et celui de solide est LP/LS. Les points L et S étant
les intersections de l’horizontale à la température q avec le
liquidus et le solidus.
Exercice d’application : Calculer les masses des phases liquide et solides de l’alliage Cu-Ni à 45% Ni à la température de 1250oC. La masse de l’alliage considéré est de 80Kg.
2.2 – Alliages binaires formant à froid deux solutions solides

|
2.2.1 – Allure générale d’un diagramme à point eutectique
Le diagramme comporte deux séries d’alliages homogènes :
· l’une riche en métal plomb et pauvre en métal étain est appelée solution solide a
· l’autre riche en métal étain et pauvre en métal plomb est appelée solution solide b
Les solutions solides sont repérées sous les branches obliques
du solidus.
Quant aux deux branches du liquidus, elles se coupent au point E
nommé point eutectique.
Ce point correspond à l’alliage eutectique dont le point de fusion qE
est inférieur à celui de tous les alliages voisins formés
des mêmes constituants.
Interprétation du diagramme
a) Solidification de l’alliage eutectique
Considérons l’alliage eutectique à 63% Sn.
Pour
une température légèrement supérieure à qE
(185 oC ), l’alliage est entièrement liquide. A la température
qE =185 oC , il y a équilibre entre le liquide
et les solutions solides a à 19 % Sn et b à 94 % Sn.
Liquide
E * solution solide a à 19 % Sn + solution solide b à 94
% Sn
La
solidification se faisant en température constante est composée
de deux solutions solides (a et b ) qui ont donné naissance à
un mélange hétérogène. Cette réaction
est appelée transformation eutectique.
une solution solide a à e1( 19 % Sn)·
une solution solide b à e2( 94 % Sn) ou de deux constituants·
une
solution solide a proeutectique + eutectique E·
une solution solide b proeutectique + eutectique E EXERCICE D’APPLICATION
Calculer
la masse des phases et des constituants d’un alliage à 80 % Sn (20 %
Pb) à la température ordinaire. La masse totale de l’alliage est
de 65 Kg (voir diagramme Pb-Sn ).
|
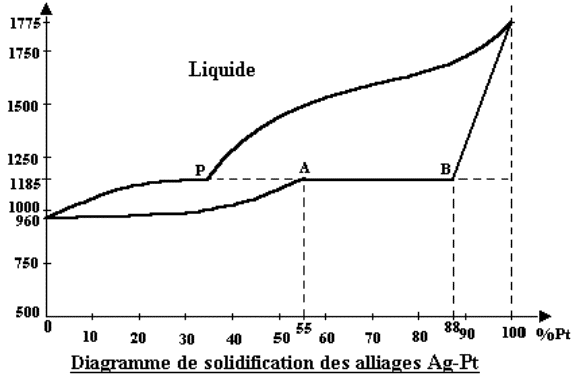
2.2.2 – Allure générale d’un diagramme
à point péritectique
Dans ce diagramme, le liquidus et le solidus n’ont pas de point de rencontre (sauf pour 0% et 100% Pt). Le point P, intersection du liquidus et du prolongement de l’horizontale du solidus, est appelé point péritectique du diagramme.
Interprétation du diagramme :
* sous les branches obliques du solidus se trouvent les solutions solides a et b.
* Sous la branche horizontale du solidus se trouvent les alliages hétérogènes.
La transformation peritectique correspond aux relations suivantes :
Entre
P et A : Liquide P + Sol. Sol. b à 88% Pt * Liquide P + Sol.
Sol. a à 55% Pt
Entre
A et B : Liquide P + Sol. Sol. b à 88% Pt * Sol. Sol. a à
55% Pt + Sol. Sol. b à 88% Pt
2.3
– Alliages binaires formant à froid plus de deux solutions solides
2.3.1
– Cas général
Ces types de diagrammes peuvent présenter plusieurs solutions solides ainsi que des eutectiques, des combinaisons chimiquement définies et éventuellement des peritectiques .
2.3.2
– Etude des combinaisons chimiquement definies
Une combinaison chimiquement définie (c.c.d) correspond à un maximum relatif commun du solidus et du liquidus. Sa température de solidification est supérieure à la température de début de solidification des alliages de la composition la plus voisine. C’est le cas de C1 et de C2 sur le diagramme Cu-Mg.
2.3.3
– Recherche de la formule des combinaisons chimiquement définies
Le problème se pose toujours de la même façon .
Exemple
Quelle est la formule chimique correspondant à une combinaison contenant 43,5 % de Mg (voir diagramme de solidification des alliages Cu-Mg). Cu = 63,5 g/mole Mg = 24 g/mole.
