 |
1.2- Constituant de latome : Un atome est constitu้ dun noyau autour duquel gravitent des ้lectrons.
I-
CONSTITUTION DE LATOME
1.1- D้finition : Latome est la plus petite quantit้ dun ้l้ment qui puisse entrer en combinaison pour former une mol้cule.

1.2- Constituant de latome :
Un atome est constitu้ dun noyau autour duquel gravitent des ้lectrons.
1.2.1- Le noyau : Il est essentiellement form้ de deux particules :
* Le proton : Il a une masse mp de 1,67.10-27 Kg et une charge ้lectrique positive e = 1,6.10 C
* Le neutron : La masse du neutron est ้galement sup้rieure เ celle du proton. Il ne porte pas de charge ้lectrique.
1.2.2- L้lectron : Chaque ้lectron porte une charge ้lectrique n้gative de m๊me valeur absolue que celle du proton. Il est plus de mille fois moins lourd que le proton.
Sa masse est :
M = mp / 1840 = 1,67.10-27 /1840 = 0,91.10-30
Kg
1.3-
Charge et masse dun atome :
1.3.1- Charge : Dans un atome, le nombre d้lectrons est ้gal au nombre de protons ( Z ). Il en r้sulte que la charge ้lectrique totale dun atome est nulle.
Z est appel้ nombre atomique ou num้ro atomique. Il correspond au nombre d้lectrons ou de protons.
1.3.2- Masse : La masse de latome est concentr้e dans le noyau. Son volume est tr่s r้duit et sa masse volumique tr่s grande.
Remarques :
1.
Une mole datomes est une quantit้ arbitraire contenant N
= 6,02.1023 atomes r้els. N
est appel้ nombre dAvogadro.
2. La masse en grammes dune mole datomes est appel้e masse atomique et elle est d้sign้e par la lettre A.
Donc la masse dun atome est le rapport qui existe entre la masse atomique et le nombre dAvogadro.
m
= A / N
Masse atomique des principaux ้l้ments m้tallurgiques
El้ments |
A |
El้ments |
A |
El้ments |
A |
El้ments |
A |
|
Aluminium |
27 |
Carbone |
12 |
Molybd่ne
|
96 |
Silicium |
28 |
|
Antimoine |
122 |
Chlore |
35,5 |
Nickel |
59 |
Sodium |
23 |
|
Argent |
108 |
Chrome |
52 |
Niobium |
93 |
Soufre |
32 |
|
Azote |
14 |
Cobalt |
59 |
Or |
197 |
Tantale |
181 |
|
Baryum |
137 |
Cuivre |
63,5 |
Oxyg่ne |
16 |
Titane |
48 |
|
B้ryllium |
09 |
Etain |
119 |
Phosphore |
31 |
Tungst่ne |
184 |
|
Bismuth |
209 |
Fer |
56 |
Platine |
195 |
Uranium |
238 |
|
Bore |
11 |
Hydrog่ne
|
01 |
Plomb |
207 |
Vanadium |
51 |
|
Brome |
80 |
Magn้sium
|
24 |
Potassium |
39 |
Zinc |
65 |
|
Cadmium |
112 |
Mangan่se
|
55 |
S้l้nium |
79 |
Zirconium |
91 |
II
- REPษRAGE DES DIRECTIONS ET PLANS CRISTALLOGRAPHIQUES DE DENSITษ
MAXIMALE
2.1 Direction cristallographique de densit้ maximale :
D.C.D.M.
Une D.C.D.M. est une direction le long de laquelle les atomes sont tangentes entre eux.
2.2 Plan cristallographique de densit้
maximale : P.C.D.M.
On appelle P.C.D.M. un plan qui passe par trois atomes non align้s du r้seau. Il contient au moins deux D.C.D.M. s้cantes entre elles.
 |
 |
Pour une maille cubique centr้e, les D.C.D.M. sont au nombre de quatre :
Remarque : Les DCDM contiennent toute l'atome centrale de la maille cubique centrée.
Les Plans C.D.M. sont au nombre de six :
2.4 Cas dune maille cubique เ faces centr้es :
Pour une maille
cubique เ faces centr้es, le nombre de D.C.D.M. est de six :
(2,4) ; (2,7); (4,7); (1,3); (1,6); (3,8)
Deux directions // sont considérées confondues
 |
 |
Les P.C.D.M. sont au nombre de huit :
 |
 |
Pour une maille compacte, le nombre de D.C.D.M. est de trois.
Les P.C.D.M. sont au nombre de quatre et correspondent aux plans de base de lhexagone
III
DษTERMINATION DU DIAMศTRE
DES ATOMES
Pour la d้termination du diam่tre, nous consid้rons pour chaque cas le P.C.D.M.
3.1
Maille cubique centr้e
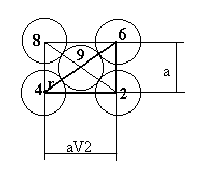
Consid้rons le P.C.D.M. (2-6-8-4 ) et soit le triangle 4-2-6. Calculons le diam่tre
de latome.
. . . . .
3.2
Maille cubique เ faces centr้es :

Soit le P.C.D.M. ( 2-7-4 ). Calculons le diam่tre de latome.
. . . . .
3.3
Maille hexagonale compacte

Soit la base hexagonale (1-2-3-4-5-6 ) , calculons le diamètre de
l'atome
. . . . .