Epidemiologia
da infecção pelo vírus da hepatite C no Brasil
Relatório
do Grupo de Estudo da Sociedade Brasileira de Hepatologia*
INTRODUÇÃO
”Uma doença sem um agente
biológico identificado". Durante várias décadas esta questão foi
uma constante interrogação aos pesquisadores e estudiosos da história
natural das hepatites pós-transfusionais não A-não B. Nos
primeiros anos da década de 80, estudos experimentais em primatas e
desenvolvidos no Centro de Controle de Doenças de Atlanta (EUA), revelaram
a presença de um agente infectivo com 60nm de diâmetro, revestido de
um invólucro lipoprotéico, genoma constituído de ácido ribonucleido (ARN),
classificado inicialmente como pertencente à família Togoviridae
e transmissivel mediante sangue e hemoderivados(1).
No momento da descoberta, Daniel Bradley e colaboradores o denominaram de Agente
de Forma Tubular.
Em 1989, mediante a sucessivos estudos de biologia molecular,
Michael Houghton e colaboradores identificaram finalmente o genoma do
agente viral responsável por 80 a 90% das hepatites pós-transfusionais não
A e não B(2). Tal agente foi denominado de
"vírus da hepatite C", apresentando características biológicas
peculiares que o diferenciam dos outros agentes virais hepatotrópicos(3).
Após a clonagem do vírus da hepatite C (VHC) e uma seqüência de
descobertos, tais como: a expressão da proteína viral recombinante; o
desenvolvimento de testes imunológicos específicos; a análise de sua
seqüência nucleotídica e o conhecimento de sua elevada taxa de mutação,
permitiram- nos conhecer em um breve espaço de tempo informações
importantíssimas sobre os principais aspectos biológicos do VHC, o
perfil epidemiológico da infecção e a história natural da doença.
Com relação aos seus aspectos biológicos, o genoma do VHC é
constituído por uma molécula de ARN em cadeia simples e polaridade
positiva, com aproximadamente 10.000 núcleotídeos(2).
A análise da seqüência nucleotídica deste vírus revelou
homologia entre dois membros da família Flaviviridae (vírus da
Febre Amarela, Dengue) e como também da família Pestiviridae(4.5).
0 genoma do VHC, como outros vírus constituídos de ARN apresenta um
notável grau de variabilidade, determinando variações de sua seqüência,
e conseqüentemente mutação genética. A análise comparativa de sua seqüência
evidenciaram a existência de pelo menos seis genótipos Virais(6, 7,
8), subtipados como
1a/1 b, 2a/2b, 3a, 4, 5, 6, de acordo com classificação proposta por
Simmonds e colaboradores(9).
Estudos recentes revelam uma
distribuição geográfica diferenciada quanto aos subtipos do VHC(10),
predominando os subtipos 1 a e 1b nos Estados Unidos, Japão, Europa e América
latina, enquanto os subtipos 2a e 2b tem uma distribuição universal. Os
subtipos 3a e 5 são observados com maior prevalência em países da América
do Sul, e em menor grau na Europa e Estados Unidos. 0 subtipo 4 é endêmico
no Egito, Gabão e em países do Oriente Médio e o subtipo 6 predomina em
doadores de sangue, nativos de Hong Kong. Numerosos estudos sugerem que a
elevada heterogenicidade do VHC tenha implicação patogênica, terapêutica
e preventiva(11, 12, 13).
0 perfil epidemiológico da infecção pelo VHC é tão complexo
quanto história a natural da doença ocasionada por este agente viral.
Circulando no sangue em baixos títulos, o VHC tem como principais
mecanismos de transmissão o sangue infectado e seus hemoderivados. Nos
Estados Unidos da América do Norte, estudos em caráter prospectivo e
realizados pelo Instituto Nacional de Saúde(14) revelaram um
decréscimo importantíssimo da infecçâo pelo VHC após a realização
do teste para a detectação do anti-HCV, como rotina nos bancos de
sangue.
No período de 1960 a 1991, de cada 100 indivíduos receptores de
produtos sangüíneos, 5 a 15% destes infectaram-se com o VHC. De acordo
com estes estudos, no momento atual o risco de transmissão do VHC por
transfusão sangüínea é de 1:103.000, ou seja, quase nulo. Na Itália,
a incidência de hepatite C pós-transfusional por 1.000.000 de habitantes
alcançou níveis de 7,5% em 1986 e de 0,4% em 1993, revelando estes dados
uma queda importantíssima na transmissão do VHC por transfusão sangüínea(15).
Recentemente, com o advento de testes sorológicos mais sensíveis, por
biologia molecular, e já em uso em países de primeiro mundo, o
risco de se infectar com VHC por transfusões de sangue e seus
hemoderivados é zero, 1:2.700.000.
Independente do risco
"quase zero" de transmissão do VHC por produtos sangüíneos,
devemos considerar que outros mecanismos de transmissão são capazes de
infectar uma pessoa com este vírus, tais como: o uso de drogas
intravenosas (toxicômanos); transplante de órgãos por parte de doadores
infectados; uso de cocaína intra-nasal e promiscuidade sexual.
Estudos recentes identificaram que 75% dos pacientes infectados
pelo VHC tinham como principal fonte de infecção a via parenteral, seja
de forma aparente, inaparente, direta ou indireta(16).
Peculiar, a transmissão do VHC por via parenteral inaparente direta
estaria provavelmente localizada no ambiente familiar, tendo como fatores
epidemiológicos a exposição e transmissão por lesões cutâneas e de
mucosa. Por outro lado, a transmissão por via parenteral inaparente
indireta poderia estar relacionada com o contacto íntimo prolongado ou
através da contaminação de instrumental e utensílios contaminados com
sangue infectado. Porém, até o presente momento, não existem evidências
de transmissão familiar ou sexual, quando os contactos específicos do
caso índex foram testados(17).
Com relação à transmissão vertical (materno-fetal) e de acordo
com Ohto e colaboradores(18), esta ocorreria em apenas 5,65%
dos casos e estaria relacionada com os altos títulos do HCV-RNA
circulante materno (1.000.000 de genoma/ml).
A infecção pelo VHC tem uma distribuição universal e as suas
altas taxas de prevalência estão diretamente relacionadas com os
chamados grupos de riscos (hemofílicos, pacientes hemodialisados,
receptores de múltiplas transfusões de sangue, recém-nascidos de mães
portadoras, toxicômanos). Nestes, dois grupos chamam a atenção, os
hemofilicos e pacientes hemodialisados. Nos hemofilicos, a prevalência de
infecção pelo VHC varia de 53% a 89% em vários países do mundo(19)
e no Brasil observam-se índices de 87,3%(20), enquanto nos
pacientes hemodialisados verificamos percentuais que
variam de 19,0% a 47,2%(21, 22, 23). Finalmente, em pacientes
com hepatite crônica pós-transfusional não A e não B, a prevalência
deste vírus alcança percentuais alarmantes, como o observado em
determinadas áreas geográficas do mundo, Espanha 85,0%, Alemanha 70% e
Egito 82%(21, 24, 25).
Na população em geral, os índices de prevalência variam de região
para região. Na maioria dos países da Europa Ocidental e na América do
Norte, a prevalência varia de 0,1% a 2,0%, enquanto em determinadas áreas
do Mediterrâneo este percentual alcança 2,9% da população estudada(14,
15, 26). As maiores taxas de prevalência são observadas na África,
com percentuais que variam de 6,0% a 12,5%(27). Estudos
dirigidos quanto à prevalência de infecção pelo VHC em doadores sangüíneos
revelam índices menores em países da Europa Ocidental, variando de 0,3%
a 0,8% e outros bastante significativos em determinadas áreas da Ásia e
África, 2,0% e 13,6%, respectivamente. Na América do Norte, a taxa média
de prevalência entre os seus doadores sangüíneos está em torno de
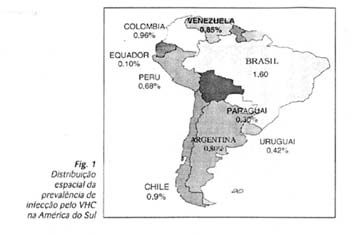
0,16%(17). A prevalência de infecção pelo VHC na América do
Sul é estimada por estudos realizados em amostras de pré-doadores de
sangue(28, 29). Na figura 1 podemos observar sua, distribuição
espacial.
De acordo com a figura 1, observamos que o Brasil apresenta a maior
taxa de prevalência de infecção pelo VHC neste subcontinente, apesar de
que
o número de amostras e o grupo estudado não represente um universo
verdadeiro(29).
|
|
Complexa, a história natural da infecção pelo
VHC tem sido extensiva- mente estudada(3, 4, 30-33),
e diversos fatores podem influir em sua evolução (uso
do álcool, carga viral, genótipo, co-infecção com
outros vírus hepatotrópicos, associação com HIV).
Contudo, e de acordo com a literatura dis poníve(34-37),
sabemos que apesar do VHC ser um agente de baixa
infectividade e replicação lenta, 50 a 80% dos
pacientes que apresentam sua forma aguda de hepatite
evoluem com uma infecção persistente, assintomática
e, em torno de 10 anos, teriam uma hepatite crônica
ativa e com progressão para cirrose hepática após
sete anos. Com o quadro definido de cirrotização, em
uma média de 13 anos este paciente poderá apresentar
um quadro de hepatocarcinoma. Com relação à
expectativa de vida entre os pacientes com cirrose hepática
pelo VHC, estudos realizados na Europa revelam que, em
pacientes com cirrose hepática compensada pelo VHC esta
foi de 91% até cinco anos e de 79% após 10 anos,
enquanto nos pacientes com cirrose hepática
descompensada não chega a cinco anos(34).
Nos Estados Unidos da América do Norte, morrem
anualmente oito mil pessoas em conseqüência de doença
hepática (cirrose e hepatocarcinoma) ocasionada pelo
VHC(38). Conforme os autores deste estudo,
nos próximos 10 anos morrerão 24 mil e em 20 anos, 74
mil. No presente momento, a principal causa de
transplante hepático entre os americanos do norte está
relacionada à doença hepática crônica pelo VHC.
Evidências de que o VHC participe efetivamente
como fator etiológico da carcinogênese hepática primária
foram demonstradas por Linke e colabora- dores através
de estudos experimentais em primatas(39). Ao
considerarmos a alta prevalência do VHC em pacientes
com hepatocarcinoma no mundo, 28 a 75% na Europa, 29 a
41% nos Estados Unidos da América do Norte, 6 a 55% no
Extremo Oriente e 29 a 58% na África(40), e
sabedores que muitos casos de hepatocarcinoma associado
ao VHC ocorrem na presença de cirrose(41),
devemos considerar que existe um grande risco de uma
pessoa infectada cronicamente pelo VHC desenvolver
hepatocarcinoma(42).
Até o presente momento ainda não está claro
qual o verdadeiro mecanismo patogênico do VHC na
necrose dos hepatócitos. Todavia, existe um consenso
que a necrose hepatocitária seja mediada pelo sistema
imunitário do hospedeiro, como também através de um
efeito citopático direto(43). Independente
desta discussão, a infecção por este agente viral
pode causar manifestações extra-hepática, citando
como exemplos a Crioglobulinemia, Glomerulonefrite
membrano-proliferativa, Lichen plannus, Síndrome de Sjõgren,
Púrpura trombocitopênica idiopática, Fibrose
pulmonar, alterações da Tireóide e Artrite reumatóide(44).
Existem relatos também que o VHC esteja associado a
determinadas doenças como a Porfiría cutânea tarda(45)
e a Esquistossomose mansoni na forma hepato-espiênica(46).
Estima-se que existam no mundo 200 milhões de
pessoas infectadas pelo VHC, grande parte destas
assintomáticas e sem conhecimento do estado de portador
do VHC e, o que é mais grave, 99,99% destes teriam doença
hepática, seja de caráter incipiente ou uma forma
mais agressiva.
Considerando que a infecção pelo VHC represente
neste momento um dos mais sérios problemas de Saúde Pública
no mundo, e que as fontes de informação sobre este
problema no Brasil são ainda incipientes, a Sociedade
Brasileira de Hepatologia e sua Comissão Científica
decidiram realizar um inquérito nacional sobre o
"perfil epidemiológico da infecção pelo vírus
da hepatite C", cujos resultados seriam discutidos
em forma de um Fórum, durante a programação científica
do XIV Congresso Brasileiro desta Sociedade. 0
Presidente e o Comitê Científico da Sociedade
Brasileira de Hepatologia nos delegou a coordenação e
o relato deste estudo em nosso país, no qual a princípio
elaboramos um questionário, enviado posteriormente aos
membros efetivos desta Sociedade e a instituições
nacionais envolvidas no estudo das hepatites virais.
MATERIAL
E MÉTODOS
Como fonte primária de informação para a
elaboração do questionário sobre o "perfil
epidemiógico da infecção pelo vírus da hepatite C no
Brasil", foi utilizada como instrumento uma intensa
revisão bibliográfica sobre os principais aspectos
epidemiológicos da infecção pelo VHC no mundo,
segundo os objetivos do presente estudo. Identificados
estes aspectos, o questionário constava de 19 questões.
Para a análise e discussão dos dados, o referido
questionário continha variáveis codificadas.
0 referido questionário foi enviado a 66 membros
efetivos da SBH (lista nominada pela SBH), e a 27
Hemocentros oficiais do Brasil. Finalmente, como fontes
secundárias de informação a este estudo, recorreu-se
a publicações científicas relacionadas à infecção
pelo VHC no Brasil.
RESULTADOS
Dos 93 questionários enviados aos membros
efetivos da Sociedade Brasileira de Hepatologia e a
Instituições (Hemocentros) para fins de participação
deste inquérito, apenas 30 (32,3%) responderam o mesmo.
Destes, 26 (86,6%) foram preenchidos devidamente,
conforme os objetivos preestabelecidos no presente inquérito
epidemiológico.
Considerando os dados contidos nos referidos
questionários e após análise destes, observamos os
seguintes resultados:
1) Início dos testes sorológicos para a detectação
do anti-HCV como rotina em nosso país
Tendo
como fonte principal de informações os Hemocentros,
verifica- mos que a maioria destes introduziram em 1992,
como rotina, os testes para a detectação do anti-HCV
na triagem para as seleção de pré-doadores de sangue.
Todavia, em determinadas regiões do Brasil, citando
como exemplo a região Sudeste, tal rotina foi
estabelecida em 1990 e 1991.
2) Métodos utilizados na detectação do
anti-HCV
De
acordo com a análise destes resultados, observamos que
80,7% das Intituições e Serviços utilizam como meio
de diagnóstico para a detectação do anti-HCV, o método
ELISA (Y geração) e 19,3% o método ELISA de 2o
geração
3) Prevalência da infecção pelo VHC por grupos
ou categoria de risco
3.1)
Pré-doadores de sangue
Dos 1.173.406 pré-doadores de sangue avaliados
no presente estudo e residentes em diversas regiões
geográficas do Brasil, 14.527 (1,23%) foram reativos
para o anti-HCV. Na tabela 1 observamos a prevalêncla
da infecção pelo VHC em indivíduos pertencentes a
este grupo, segundo regiões geográficas. Na figura 2,
verificam-se os resultados da distribuição espacial da
prevalência do VHC, segundo os Estados federativos
brasileiros.
|
|
|
|
|
3.2)
Doenças hematológicas
Os resultados quanto à prevalência do VHC neste grupo
foram distribuí- dos de acordo com a especificação da
patologia, como podemos observar na tabela 2.
3.3)
Hemodialisados
No grupo de pacientes hemodialisados, observamos um total
de 2.078 pacientes estudados, sendo que 797 (38,5%) foram reativos
para o anti- HCV. Na tabela 3, analisa-se a prevalência do VHC
neste grupo por regiões geográficas.
3.4)
Outros grupos ou categorias de riscos
Com relação a outros grupos ou categorias de riscos aqui
estudados, estes foram distribuídos e classificados como: alcoólatras,
contactantes do VHC, meninos de rua, pacientes HIV positivo,
profissionais de saúde, politransfundidos antes de 1991,
politransfundidos depois de 1991, presidiários e prostitutas. Os
resultados da prevalência do VHC nos grupos citados, encontram-se
na tabela 4.
3.5)
Doença hepática crônica
Para a análise dos resultados da prevalência de infecção
pelo VHC, estes pacientes foram divididos em dois grupos. 0
primeiro (grupo 1) foi estabelecido por nós como doença hepática
crônica em razão da maioria dos da- dos contidos nos questionários
terem sido condensados, sem especificação do tipo de patologia
estudada. 0 segundo grupo (grupo 2) também foi classificado por nós
como doença hepática crônica especificada de acordo com a
entidade nosológica relatada pelos investigadores e instituições
participantes deste estudo.
No grupo 1, 1.839 pacientes foram estudados para a presença
do anti- HCV, mostrando-se 659 (35,83%) reativos. Os resultados
que aparecem na tabela 5 mostram a prevalência de infecção pelo
VHC neste grupo, de acordo com as regiões geográficas. Nos
pacientes pertencentes ao grupo 2, os resultados encontram-se na
tabela 6.
|
|
3.6)
População geral e grupos populacionais específicos
Os resultados obtidos nestes grupos foram provenientes de populações
classificadas em diferentes categorias, e os resultados da prevalência
do VHC encontram-se na tabela 7.
3.7)
Doenças dermatológicas
No grupo de pacientes com doenças dermatológicas os resultados
quanto à prevalência de infecçào pelo VHC encontram-se na
tabela 8.
3.8)
Genótipos e subtipos do VHC
Nas tabelas 9 e 10, observamos os genótipos e subtipos do VHC
mais comumente encontrados em quatro Estados federativos
brasileiros (Amazonas, Rio de janeiro, São Paulo, Rio Grande do
Sul).
COMENTÁRIOS
A difusão de um agente infectivo em uma determinada
comunidade e as conseqüências de seus resultados representam um
universo preocupante aos setores de Saúde Pública em todo mundo.
A condição "sine qua non" para definir estratégias no
controle deste agente infectivo está baseada no pleno e real
conhecimento de sua amplitude e disseminação na comunidade, seja
esta científica ou leiga. A princípio, os resultados obtidos
neste inquérito quanto aos aspectos epidemiológicos da infecção
pelo VHC no Brasil revelam dados preocupantes e até então
desconhecidos, inclusive por todos nós.
Como anteriormente relatado, estudos em caráter
prospectivo e realiza- dos nos Estados Unidos da América do Norte
revelaram um decréscimo importantíssimo da infecção pelo VHC
após a realização do teste para a detectação do anti-HCV,
como rotina nos bancos de sangue. Antes de 1991, de cada 100 indivíduos
receptores de produtos sangüíneos, 5 a 15% destes
infectaram-se com o VHC(14).
Em nosso país e de acordo com os resultados obtidos no
presente inquérito, somente em 1992, grande parte dos Hemocentros
oficiais introduziram como rotina os testes para a detectação do
anti-HCV na triagem para a seleção de bolsas de sangue. Se
considerarmos tal informação oficial, poderemos sugerir que
durante um grande período de tempo, e até décadas, uma
significativa parcela de receptores de sangue em nosso país
infectaram-se com o VHC. Corroborando com as nossas considerações
e segundo informações analisadas no presente estudo, podemos
verificar na tabela 5 que antes da introdução da rotina para a
detectação do anti-HCV em nosso país pelos Hemocentros 18,00%
dos politransfundidos estavam infectados pelo VHC e, após a
introdução desta rotina, apenas 1,38% destes infectaram-se com
este vírus.
Infelizmente, por razões metodológicas e informações
incompletas, não foi possível caracterizar no presente estudo
qual ou quais os principais fatores de risco na transmissão do
VHC em nosso país. Todavia, uma simples análise dos resultados
encontrados em determinados grupos ou categorias de risco, citando
como exemplo os pacientes com doenças hematológicas (tabela 2),
hemodialisados (tabela 3) e grupos ou categorias de alto risco
(tabela 4), faz-nos identificar a princípio, e de acordo com a
literatura(16, 19, 20, 23), os prováveis mecanismos de
transmissão do VHC em nosso país. Revisando a literatura
brasileira sobre a questão, observamos que o principal fator de
risco associado à infecção pelo VHC estaria em grande parte
relacionado à transmissão parenteral(47, 50),
independente dos grupos estudados. Devemos caracterizar como área
endêmica de infecção pelo VHC aquelas regiões em que as taxas
de prevaiência na população geral seja igual ou superior a
1,0%. No presente estudo, apesar de que não podemos caracterizar
o grupo de pré-doadores de sangue como população geral e sim
apenas uma parte desta, observamos que a prevalência do VHC entre
estes é alta (1,23%), o que caracterizaria nosso país como uma
área endêmica de infecção pelo VHC. 0 estudo comparativo entre
doadores de sangue e seus resultados quanto à prevalência do VHC
por regiões geográficas do nosso país revelou um nítido
contraste. Efetivamente, enquanto na região Norte os índices de
prevalência foram maiores que 2,0%, verificamos que, na região
Sul do país, estes foram menores que 0,7%. Ao analisarmos estes
dados, podemos sugerir que no presente momento a região Norte tem
a maior taxa de prevalência de infeccão pelo VHC no Brasil e uma
das maiores do mundo, só comparada a algumas regiões da Ásia(51),
África(27) e Europa Oriental(52). Em suma,
quando analisamos esta prevalência por Estados federativos,
verificamos que os maiores índices são encontrados exatamente no
Estado do Acre (5,9%), Estado este situado na região Norte.
Excluindo o Estado do Acre, temos no Estado do Rio de janeiro
(região Sudeste) uma das maiores taxas de prevalência do VHC
(2,66%) no Brasil.
Com relação aos grupos ou categorias de risco aqui investigados,
citando como exemplos os pacientes hemodialisados e hemofilicos,
os resulta- dos da prevalência de infecção pelo VHC no Brasil
(38,35%) são similares aos observados em diversos países do
mundo(21.23). Quando analisamos a distribuição da prevalência
do VHC por regiões no grupo de pacientes hemodialisados,
verificamos que as maiores taxas são encontradas nas regiões
Norte (45,50%) e Sul do país (43,64%).
0 estudo comparativo quanto à prevalência do VHC em outros
grupos de ou categorias de risco (tabela 4) revelou aspectos
epidemiológicos que de- vem ser realçados e comentados, a começar
pelos índices de 46,2%,15,80% e 13,00% encontrados em presidiários,
Prostitutas e pacientes HIV*, respectivamente. Estas altas taxas
observadas no presente estudo sugerem que a transmissão sexual e
parenteral (uso de drogas injetáveis) devam ser incriminadas como
os mais importantes mecanismos de transmissão do VHC nestes
dois grupos ou categorias de
risco.
|
|
|
|
Em relação à prevalência do VHC em pacientes com doença hepática
crônica, observamos altas taxas em todas as regiões do Brasil,
variando de 17,00% a 58,25%, o que confirma a importância da
infecção por este agente viral na etiopatogenia desta entidade
nosológica. Um fato importante observado neste estudo foi que,
apesar da região Norte apresentar os maiores índices de prevalência
para o VHC entre pré-doadores de sangue e em populacão geral do
Brasil, a prevalência do VHC entre hepatopatas crônicos foi uma
das menores encontradas (20,66%), quando comparada por exemplo com
a região Sudeste (58,25%) e Sul (58,18%). Infelizmente, com os
dados disponíveis no presente estudo, não temos condições de
analisar ou de expressar opiniões sobre a relevância do fato.
Por outro lado, a prevalência do VHC nos pacientes com doença
hepática crônica especificada, revela dados interessantes,
principalmente no que tange às altas taxas encontradas em
pacientes com doença alcoólica (25.00%), cirrose hepática
(22,65%), hepatite auto-imune (22,00%) e hepatite crônica criptogênica
(11,00%). Todavia, surpreendentemente, entre pacientes com
hepatocarcinoma a prevalência do VHC foi de apenas 8,51%,
provavelmente uma das menores do mundo quando comparada com as
taxas de 29,00% a 76,00% observadas por McFarIane e
colaboradores(53).
Novamente a análise dos resultados deste inquérito chama-nos a
atenção quanto à prevalência do VHC encontrada na população
geral e grupos populacionais específicos (tabela 7). Com relação
à população geral, o número de indivíduos estudados não
representa um universo estatístico, porém, nos chamados grupos
populacionais específicos, assim denominados por nós,
verificamos que entre indígenas brasileiros a prevalência do VHC
alcançam percentual de 19,50%, percentual
este 13vezes maior do que o encontrado na população
geral. De acordo com estes resultados, podemos sugerir que entre
indígenas brasileiros o VHC circula ativamente. Enfim, sem
podermos caracterizar profundamente tal achado epidemiológico em
decorrência exclusiva da falta de maiores informações,
acreditamos que estudos posteriores devam ser realizados entre
estes, para sabermos qual ou quais os mecanismos de transmissão
do VHC na referida comunidade.
Entre pacientes com doenças dermatológicas, os maiores índices
de prevalência do VHC estavam situados em dois tipos de
patologia, 12,23% na hanseníase e 7,50% nos pacientes com Lichen
plannus. Contudo, em pacientes com pênfigo foliáceo e psoriase,
não observamos positividade para o anti-HCV. Estudos recentes
revelam uma significativa prevalência do VHC entre pacientes com
Lichen plannus(54) e segundo estes autores tal entidade dermatológica
poderia estar associada a manifestações extra-hepáticas do VHC.
Com relação à prevalência dos genótipos do VHC, observamos no
presente estudo um maior predomínio dos genótipos 1 e 3 (tabela
9), resultados estes que confirmam pesquisas anteriores no
Brasil(10) e são similares aos observados em outras áreas geográficas
do mundo(55-59). Quanto aos subtipos do VHC, verificamos uma maior
prevalência do 1b (tabela 10). Finalmente, ainda com relação
aos genótipos do VHC, observamos em nosso estudo que o tipo 3 tem
uma maior prevalência (40,09%) no Rio Grande do Sul, quando
comparado aos outros Estados federativos. De acordo com a
distribuicão geográfica do subtipo 3 no mundo, os resultados
observados no Rio Grande do Sul são semelhantes aos da Austrália(60)
e Tailândia(61).
Finalizando estes comentários, fica patente a ausência de
determinados dados epidemiológicos sobre a infecção pelo vírus
da hepatite C no Brasil. Todavia, estudos posteriores deverão ser
realizados para que possamos conhecer com maiores detalhes o
comportamento da infecção pelo VHC em nosso país,
principalmente no que tange aos aspectos demográficos e seus
principais mecanismos de transmissão.
REFERÊNCIAS
BIBLIOGRÁFICAS
1
Bradley DW. Mc
Caustland KA. Cook EH. et al. Pos-transfuston non-A, non-B
hepatilis in chimpamzees: psystcochemical evidence that the tubule
forming agent is a smoli, enveloped virus. Gastroenterology 88:
773-779.1985.
2
Choo Q-L, Kuo G, Weiner Aj, et al. Isolation of a cDNA clone
derived from a blood-borne non-A, non-B viral hepatitis genome.
Science 244: 359-362.1989.
3
HoughIon M, Miner A), Kuo G, et al. Molecular biology of the
hepatitis C viruses: implications for djagnosis, development and
controI. Hepatology 14: 381 388, 1991,
4,
Choo Q-L, Richamm KH. Han
JH, et al. Genetic
organization and diversity of the hepatitis C virus. Proceeding of
the National Academy of Sciences of the USA 88: 2451-2455. 1991.
5.
Miller RH & Purcell RH. Hepatitis C virus shares with
Pestviruses and flaviviruses as well as members of two plant virus
supergroups. Proceedings of the National Academy of Sciences of
the USA 87: 2057-2061.1990.
6.
Kato N,'Hijikata M, Ootsuyama Y, et al. Molecular
cloning of the human hepatitis C virus genome, from japanese
patients with non-A, non-B hepatitis. Proceedings of the National
Academy of Sciences of the USA 87; 9524-9528, 1990.
7.
Taikanizavia A. Mori C, Fuke I, et al. Structure and organization
of the hepatitis C virus; genome isolated from human carriers.
Journal of General Virology 71: 3027-3033, 1990.
8.
Simmonds P, Holmes E. Cha T. et al. Classification of hepatitis C
virus in six major genotypes and a series of subtypes by
phylogenetics analysis; of the NS-5 region. Proceedings of the
National Academy of Sciences of the USA 91: 101345-10348. 1993.
9.
Simmonds P, Alberti A. Alter Hj, et al. A proposed system for the
nomenclature of hepatitis C viral genomes. Hepatology 19:
1321-1324. 1994.
10.
Mc Omish F. Yap PI, Dow BC, et al. Geographical distribuition of
hepatitis C virus genotype in blood donors: an international
collaborative survey. journal of Clinical Microbiology 32; 884-
892.1994.
11.
Farci P, Alter Hj, Wong D, et al. A long-term study hepatitis C
virus reiplication in non-A. non-B hepatits. New Englandtournal
oi`Medicine 325: 98-104, 1991.
12.
Weiner Aj, Geysen HM, Christopherson C. et al. Evidence for
immune selection of hepatitis C virus (HCV) putatitive envelope
glycoprotein variants: potential role in chronic HCV infection.
Proceeding of the NalionalAcademy oíSciences of the USA 89:
346-3070,1992.
13,
Kanal K, Kako M & Okamoto H. HCV genotypes in chronic
hepatitis and response to interferon. Lancet 339: 1543, 1992.
14.
Alter Hj, Purcell RH, Shih J, et al. Detection of antibody
to hepatitis C virus in prospectively followed transfusion
recepients with acute and chronic non-A, non B hepatitis. The New
England journal of Medicine 321: 1494-1500, 1989.
15.
Chiaramonte,
M, Stroffolini T, Caporaso N, et al. Hepatitis C virus infection
in Italy: a multicentric sero-epidemiological study. Ltalian
Journal of GastroenterOlogy 23: 555-558. 1991.
16.
Conry-Cantilena. Van Raden MA, Gibbe J, et al. Routes
of infection, viremia. and liver disease in blood donors found to
have hepatitis C virus infection. The New England Journal of
Medicine 333: 1691-1696, 1996.
17.
Alter Hj. Blood donors with hepatitis C. Program and
Abstracts of NIH Consensus, Devolopment Conference (Bethesda,
Maryland-USA; March24-26.1997) Management of hepatitis C, 31-33, 1997.
18.
Ohto H, Terazawa S. Sasaki N, et al. Transmission
of hepatitis C virus from mother to infant. The England Journal of
Medicine 333: 744-750,1994.
19.
Boyer JL & Reuben A. In: Schiff 1, Shiff ER, Eds.
Diseases of (he Liver. 7th ed, Philadelphia, Lippincott
Co.: 586-637,1993.
20.
Brandão-Mello CE, Basílio de
Oliveira CA & Gonzaga AL. Hepatitis
C and liver discase in hemophilia. Hepatology 19 (4): 441.1994.
21.
Esteban fl. Esteban R.
Viladomiu L, et al. Hepatitis
C virus antibodies among risk group in Spain.
Lancet
2: 294-297, 1989,
22.
Ayola EA. Huraib
S. Arif M, et al. Prevalence of antibodies to hepatitis C virus;
among saudi haemodialysis patients. Journal of Medica] Virology
35: 155-159. 1991.
23.
Sheu J-C, Lee S-H. Wang JJ, et al. Prevalence of anti-HCV
and HCV viremia in hemodialysis patients in Taiwan. Journal of
Medical Virology 37: 108-112. 1992.
24.
Rogendorf M., Deinhardt F, Rasshofer R, et al. Antibodies
to hepatitis C virus, Lancet 2: 324- 325, 1989.
25.
EI-Zayadi
A. Selim 0, Rafjk M, et al. Prevalence
of hepatitis C virus among non-A. non-B related chronic liver
discase. Journal of Hepatology 14: 416-417,1992.
26.
Kühnl
P, Seidi S. Stangel W. et al. Antibody
to hepatitis C virus in German blood donors. Lancet 2:324.1989.
27.
Ngatchu T. Stroffolini T & Rapicetta M. Seroprevalence
of anti-HCV in an urban child population: a pilot study in a
developing area. Cameroon. Journal of Tropical Medicine and
Hygiene 91 (1); 57-61, 1992.
28.
Situación de los bancos de sangre en Ia Región de Ias Américas,
1994-1995.Boletín Epidemiológico/OPS 18 (1): 11-12, 1997.
29.
Fay 0. Schatzmayr
H, Visona J, et al. Prevalence of HVC antibodies in Latin America.
Hepatology 19 (4): 601.1994.
30.
Oshita
M, Hayashi N, Kasahara A, et al. Increased
serum hepatitis C virus RNA leveis among alcoholic patients with
chronic hepatitis. Hepatology 20: 1115-1120. 1994.
31.
Cromie
SL, Jenkis PJ, Bowden OS, et al. Chronic
hepatitis C: effect of alcohol on activity and viral titre.Journal
of Hepatology 25: 821-826.1996.
32.
Colombo
M. Kuo G, Choo Q-L. et al. Prevalence
of antibodies to hepatitis C virus; in Italian patients with
hepatocellular carcinoma. Lancet 2: 1006-1008, 1989.
33.
Soto B, Sânchez-Quisano AR, Rodrigo 1, et ai. Human
immunodeficiency virus infection modifies the natural history of
chronic parentarailly-acquired hepatitis C with an unusually rapid
progression to cirrhosis. Journal of Hepatology 26: 1-5.1997.
34.
Kiyosawa K. Sodeyama T. Tanaka, E, et al. lnterrelationship
of blood transfusion non-A, non-B hepatitis and hepatoceilular
carcinoma: analysis by detection of antibodies to hepatitis C.
Hepatology 12: 671-675, 1990.
35.
Seef LB, Buskell-Bales Z. Wright Z, et al. Long-term
mortality after transfusion-associaled non-A. non-B hepatitis. The
New England Journal of Medicine 327: 1906-1911. 1992.
36.
Yano M, Yatsuhasi H. Inoue 0, et al. Epidemiology
and long-term prognosis of hepatitis C infection in japan. Gut 34:
S1 3-S`1 6.1993.
37.
Takahashi
M. Yamada G. Miyamoto R, et al. Natural course of chronic
hepatitis C. American Journal of Gastroenterology 88: 240-243,
1993.
38.
Alter Mj. Epidemiology of hepatitis C. Program and
Abstracts of NIH Consensus Devolopment Conference (Bethesda,
Maryland-USA, March24-26.1997) Management of hepatitis C, 67.70,
1997.
39.
Linke HIL, Miller MF, Petterson DA, et al. Documentation of
hepatocellular carcinoma in an chinpanzee with non-A, non-B
hepatitis. In: Robson W, Koite K, Will H, Eds. Hepadna Viruses.
Alan R Liss, New York; 357-370,1987.
|
40.
Colombo M &Romeo R. Carcinoma epatocellulare e virus dellepatite: C
(HCV). ln: il virus dellepatite C (HCV): I infezione e la malattia. Eds
Craxi A. Alamasio P, Magrin S. V01 2, 27-42. 1995.
41.
Di Bisceglie AM. Simpsom LH. Lotze MT, et al. Devoropment or
hepatocellular carcinoma among patients with chronic liver disease due to
hepatitis C viral infection. journal Clinical of Gastroenterology 19:
222-226. 1994.
42.
Caporaso N, Romano M, Marmo R. et al. Hepatitis
C infection in an additive risk factor for
development of hepatocellular carcinoma in patients with cirrhosis.
journal of Hepatology 12: 367-371, 1991.
43.
Colombo M, Manucci PM, Brettler DB, et al. Hepatocellular carcinoma in
hemophilia. journal of Hepatology 37: 243-246. 1991.
44.
Gerber MA. Pathobiologic effects of hepatitis C. journal of Hepatology 22
(1). 83-86, 1995.
45.
De Castro M, Sárichez J, Herrera JE et al. Hepatitis
C virus antibodies and liver disease in patients with porphyria cutanea
tarda. Hepatology 17: 551-557, 1993.
46.
Pereira LMMB, Meio MCV, Saleh MG, et al. Hepatitis
C virus infection in Schistosomiasis mansoni in Brazil. journial of
Medica] Virology 45: 423-4 28, 1995.
47.
Antunes S. Lupinacci F, Rondina F. et al, infecção pelo VHC em
hemofilicos e portadores de
outras coagulopatias: prevalência e fatores associados. Gastroenterologia
Endoscopia Digestiva 14 (4): 150,1995.
48.
Fonseca JCF. Brasil I_M, Borborema CAT, et al. História Natural da doença
hepática crônica pelo
vírus da hepatite C (VHC). Gastroenterologia Endoscopia Digestiva 14 (4):
153,1995.
49.
Castilho M, Braga W, Brasil 1, et al. Comportamento e impacto da infecção
pelo VHC em hemodializados. Archivos Argentinos de Enfermedades dei
Aparato Digestivo 10 (3): 41, 1996.
50.
leite NC, Coelho HSM. Kinrys
G, et al. Heterosexual transmission of hepatitis C vírus. Archivos
Argentinos de Enférmedades del Aparato Digestivo 10 (3): 55, 1996.
51. Yap 1, Guan R. Kang)Y. et al. Seroprevalence of antibody to the
hepatitis C in Singapore. South- east Asia journal of Tropical Medicine
and Public Health 22: 581-585. 1991.
52. Laskus
T, Radkowskl M, Lupa E. et al. Hepatitis
C virus antibody in Poland. Scandinavian journal of infectious, Diseases
23: 385-386.1991.
53. McFariane IG, Smith HM, Johnson P), et al. Hepatitis C virus
antibodies in chronic active hepatitis: pathogenetic factor or
faise-positive resuits? Lancet 335: 754-757. 1990.
54.Jubert
C, PawIotsky J-M, Pouget F, et al. Lichen plannus and hepatítis C-virus
related chronic active hepatitis. Archives Dermatologic 130: 73-76,1994.
55.
Vargas He. Wang LF, Laskus T, et al. Distribuition of infecting
hepatitis C virus genotypes in end- stage liver disease patients at a
large American transplantation center. Journal of Infectious Diseases 175:
449-450. 1997
56.
Pichio GR,
Nakatsuno M. Boggiano C. et al. Hepatitis
C (HCV) genotype and viral titer distribution among Argentinean hemophilic
patients in the presence or absence immunodeficiency virus (HIV)
co-infection. journal of Medical Virology 52: 219-225.1997.
57. Pujol FH, Loureiro CIL,
Devesa M, et al. Determination
of genotypes of hepatitis C in Venezuela by restriction fragment Iength
polymorphism. journal of Clinical Microbiology 35: 1870-1872, 1997.
58.
Han CJ, Lee
HS, Kim HS, et al. Hepatitis
C virus genotypes in Korea and their relationship to clinical outcome in
type C chronic liver diseases. Korean journal of internal Medicine 12:
21-27, 1997.
59. Seme
K. Poljak M, Lesnicar G, et al. Distribuition
of hepatitis C virus genotypes in Slovenia. Scandinavian journal of
Infection Diseases 29: 29-31, 1997.
60.
McCaw R. Moaven L, Locamini AS, ct al. Hepatitis C virus genotypes
in Australia. Journal of
Viral Hepatitis 4: 351-357, 1997.
61. Kanistarion D. Neciamek M.
Dharakul T, et al. Genotypic distribution of hepatitis C virus in
different regions of Thailand. Journal of Clinical Microbiology 35:
1772-1776, 1997.
Grupo
de Estudo da Sociedade Brasileira de Hepatologia (SBH)
Coordenador
do Estudo - JCF Fonseca.
Relator do Estudo - JCF Fonseca.
Redação
–JCF Fonsoca
Estados,
Instituições e Autores principais
Estado
do Acre: Hospital das Clínicas de Rio Branco (C Lobato & FE Farias).
Estado
do Amazonas: Instituto de Medicina Tropical do Amazonas JCF Fonseca);
Fundação de Hematologia e Hemoterapia do Amazonas (D Kiesslich).
Estado
do Para: Instituto Evandro Chagas (MCP Soares); Fundação Centro de
Hemoterapia e Hematologia do Para (LMCM Pereira).
Estado
da Bahia: Universidade Federal da Bahia - Serviço de Gastro-Hepatologia
(LC Lyra).
Estado
do Ceará: Centro de Hematologia e Hemoterapia do Ceará (FPC Souza).
Estado
do Piaui: Centro de Hematologia e Hemoterapia do Piauí (L Brasil & S
Tavares).
Distrito
Federal: Sociedade de Gastroenterologia de Brasilia (MB Carvalho).
Estado
de Goiás: Universidade Federal de Goiás - Faculdade de Medicina - Serviço
de Gastroenterologia do Hospital das Clínicas (H Rosa); Universidade
Federal de Goiás - Instituto de Patologia Tropical (RR Dah0.
Estado
de Mato Grosso: Hemocentro Coordenador do Estado de Mato Grosso (PM
Borralho).
Estado
do Espírito Santo: Universidade Federal do Espírito Santo - Hospital
Universitário - Serviço de Gastroenterologia (CS Gonçalves).
Estado
de Minas Gerais: Faculdade de Medicina da Universidade Federal de Minas
Gerais - Hospital das Clínicas (J Galizzi Filho); Fundação Centro de
Hematologia e Hemoterapia de Minas Gerais (SMN Silva).
Estado
do Rio dejaneiro: Universidade Federal do Rio de janeiro - Faculdade de
Medicina - Hospital Clementino Fraga Filho - Serviço de Gastroenterologia
(HSM Coelho); Hospital Universitário Pedro Ernesto - Ambulatório de
Hepatologia (FG Alvariz); Instituto Estadual de Hemoterapia Arthur de
Siqueira Cavalcante (MR Cardoso); Centro de Hernatologia Santa Catarina
(CEB Mello).
Estado
de São Paulo: Fundação Pró-Sangue Hemocentro de São Paulo (AS Alquézar)
Escola Paulista de Medicina - Disciplina de Gastroenterologia -
Setor de Hepatites (Mil Ferraz); Instituto da Criança "Prof. Pedro
de Alcantra" do Hospital das Clínicas - Serviço de Hepatologia Pediátrica
(G Porta)
Estado
do Paraná: Centro de Hematologia e Hemoterapia do Pararia (R Rubel)
Estado
do Rio Grande do Sul: Fundação Faculdade Federal de Ciências Médicas
de Porto Alegre - Santa Casa de Porto Alegre (CA Marroní & AA
Mattos); Hospital das Clínicas de Porto Alegre - Unidade de
Gastroenterofogia Pediátrica (TR Silveira); Hemocentro do Rio Grande do
Sul (L Orfandíni).
Fonte: http://www.sbhepatologia.org.br/nacional/Epidemiologia/S3.htm
|
![]() Epidemiologia
Epidemiologia