อะตอมของไฮโดรเจน
โครงสร้างอะตอมแบบใหม่
้กำหนดลักษณะของอะตอมดังนี้
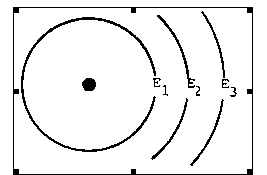
1.อะตอมแบ่งออกเป็นชั้น ๆ แต่ละชั้นจะมีพลังงานประจำตัวซึ่งมีค่าไม่เท่ากัน เรียกว่ามีระดับพลังงานต่างกัน ระดับพลังงานภายในอะตอมจะเป็นช่วง ๆ ไม่ต่อเนื่อง
2.ระดับพลังงานที่อยู่ใกล้นิวเคลียสมากที่สุดจะมีพลังงานต่ำสุด (คือ E1) เรียกว่าระดับพลังงานในสภาวะพื้น (ground state) ระดับพลังงานที่ต่ออกไปอีก คือ E2 , E3 , . …. จะมีพลังงานสูงขึ้นตามลำดับ ระดับพลังงานนอกสุดของอะตอมจะมีพลังงานในตัวสูงสุด
ตั้งแต่ระดับพลังงาน E2 , E3 , . …. เป็นต้นไป เรียกรวมกันว่า Allowed state energy
3.อิเล็กตรอนที่กระจายอยู่ในระดับพลังงานเหล่านี้จะต้องมีพลังงานในตัวเท่ากับพลังงานประจำระดับนั้นจึงจะอยู่ในสภาวะที่เสถียร และสามารถโคจรอยู่ในระดับพลังงานนั้นได้ เช่น
- อิเล็กตรอนที่จะโคจรอยู่ในระดับพลังงานที่ 1 จะต้องมีพลังงาน E1
- อิเล็กตรอนที่อยู่ในระดับพลังงานที่ 2 จะต้องมีพลังงาน E2
ถ้าอิเล็กตรอนมีพลังงานเปลี่ยนไปจากเดิมจะทำให้ไม่เสถียร เช่น
- อิเล็กตรอนที่อยู่ในระดับ E1 เมื่อได้รับพลังงานเพิ่มขึ้น จะขึ้นไปอยู่ในชั้น E2 , E3 , . …. ซึ่งทำให้ไม่เสถียร อิเล็กตรอนจะพยายามกลับมาสู่ตำแหน่งเดิมเพื่อให้อยู่ในภาวะที่เสถียรตามเดิม โดยการคายพลังงานส่วนหนึ่งออกมา
พลังงานของอิเล็กตรอนซึ่งเคลื่อนที่อยู่รอบ ๆ นิวเคลียสประกอบด้วยพลังงานศักย์ (คือพลังงานที่เกิดจากแรงดึงดูดระหว่างอิเล็กตรอนกับโปรตอนหรือกับนิวเคลียส) และพลังงานจลน์
(คือ พลังงานที่เกิดจากการเคลื่อนที่ของอิเล็กตรอน)
ปกติอนุภาคทุกชนิดจะอยู่ในภาวะที่เสถียรที่สุดเมื่อมีพลังงานในตัวต่ำที่สุด ดังนั้นในภาวะปกติผลรวมของพลังงานทั้งสองชนิดของอิเล็กตรอนจะมีค่าต่ำสุด (สมมติให้เป็น E1 ซึ่งก็คือ พลังงานในสภาวะพื้น (ground state) นั่นเอง
เมื่อมีการเผาหรือใสไฟฟ้าเข้าไป อะตอมจะได้รับพลังงานเพิ่มขึ้น ทำให้อิเล็กตรอนมีพลังงานสูงขึ้นสมมติให้เป็น E2 ซึ่งเรียกว่า “ภาวะกระตุ้น Excited state energy” ในภาวะที่ถูกกระตุ้นนี้อิเล็กตรอนจะมีพลังงานสูงขึ้น ซึ่งทำให้ไม่เสถียร และจะพยายามปรับตัวกลับเข้าสู่ภาวะปกติดังเดิม ในการกลับคืนสู่ภาวะปกติ หรือภาวะพื้นตามเดิมนั้น อิเล็กตรอนจะต้องคายพลังงานออกมาเท่ากับพลังงานที่ได้รับเข้าไป พลังงานจำนวนนี้จะเท่ากับผลต่างของพลังงานทั้งสองระดับ
ถ้าให้ ΔE = พลังงานที่อิเล็กตรอนคายออกหรือได้รับเข้าไป
ΔE = E2 - E1
พลังงานที่อิเล็กตรอนคายออกมา (ΔE)
- ส่วนใหญ่จะปรากฏอยู่ในรูปของพลังงานแสงเป็นเส้นสเปกตรัมที่มีสีต่าง ๆ ถ้าอิเล็กตรอนมีเพียง 2 ระดับพลังงาน เส้นสเปกตรัมควรจะปรากฏเป็นเส้นเดียว
- แต่จากการพิจารณาเส้นสเปกตรัมของธาตุต่าง ๆ พบว่ามีมากกว่า 1 เส้น เช่น ธาตุไฮโดรเจนมีเส้นสเปกตรัมที่ปรากฏอยู่ในช่วงแสงขาวถึง 4 เส้นด้วยกัน แต่ละเส้นจะมีความยาวคลื่นและพลังงานแตกต่างกันดังในตารางต่อไปนี้
ความยาวคลื่นและพลังงานของเส้นสเปกตรัมของไฮโดรเจน
| สีของสเปกตรัม | ความยาวคลื่น (nm) | พลังงาน (kJ) |
| สีม่วง สีน้ำเงิน สีน้ำทะเล สีแดง | 410 434 486 656 | 4.84 x 10-22 4.57 x 10-22 4.08 x 10-22 3.02x 10-22 |
ข้อสรุปที่ได้จากเส้นสเปกตรัมของไฮโดรเจน
1. การที่ไฮโดรเจนมีเส้นสเปกตรัมให้เห็นถึง 4 เส้น แสดงว่าภายในอะตอมจะต้องไม่ได้มีเพียง 2 ระดับพลังงานเท่านั้น
2. การที่ความยาวคลื่นไม่ได้ต่อเนื่องกัน แสดงว่าระดับพลังงานในอะตอมควรจะเป็นช่วงไม่ต่อเนื่องกัน
ระดับพลังงานในอะตอมของไฮโดรเจนจะต้องมีระดับที่ 3, 4, …. ต่อ ๆ ไป ซึ่งจัดเป็นชั้น ๆ การที่มีระดับพลังงานหลายระดับ
แต่ละระดับมีค่าพลังงานคงที่ทำให้ผงต่างระหว่างระดับพลังงานคู่หนึ่ง ๆ มีค่าไม่เท่ากัน แต่เป็นค่าคงที่
เช่น
ΔE = E2 - E1
ΔE = E3 - E1
ΔE = E4 - E1
เมื่อผลต่างของระดับพลังงานคู่หนึ่ง ๆ มีค่าไม่เท่ากัน พลังงานในส่วนที่คายออกมาจึงมีค่ไม่เท่ากันด้วย ทำให้มีเส้นสเปกตรัมได้หลายเส้นสรุปการเกิดสเปกตรัมของธาตุ
1.เมื่ออิเล็กตรอนได้รับพลังงานจะถูกกระตุ้นให้ขึ้นไปอยู่ระดับพลังงานที่สูงขึ้น ซึ่งจะขึ้นไปอยู่ระดับใดย่อมขึ้นกับปริมาณพลังงานที่ได้รับ การที่อิเล็กตรอนขึ้นไปอยู่ในระดับพลังงานที่สูงขึ้นนี้ทำให้อะตอมไม่เสถียร อิเล็กตรอนจึงพยายามกลับมาสู่ระดับพลังงานเดิมโดยการคายพลังงานออกมาค่าหนึ่ง
ซึ่งเท่ากับพลังงานที่ได้รับเข้าไปพลังงานส่วนใหญ่ที่คายออกมาจะอยู่ในรูปของคลื่นแม่เหล็กไฟฟ้า ซึ่งปรากฎเป็นเส้นสเปกตรัมที่มีสีต่าง ๆ กันในสเปกโตรสโคป
2.การเปลี่ยนระดับพลังงานของอิเล็กตรอนไม่จำเป็นจะต้องเกิดระหว่างระดับพลังงานที่อยู่ถัดกัน แต่อาจจะมีการเปลี่ยนข้ามขั้นได้ จึงเป็นเป็นเหตุให้มีเส้นสเปกตรัมเกิดขึ้นได้หลายเส้น
3.ภายในอะตอมซึ่งแบ่งพลังงานเป็นชั้น ๆ ระดับพลังงานที่อยู่ใกล้นิวเคลียสจะต่ำที่สุด และระดับพลังงานที่อยู่ห่างจากนิวเคลียสมากที่สุดจะมีค่าสูงสุด ดังนั้นอิเล็กตรอนในระดับพลังงานต่ำจึงอยู่ใกล้นิวเคลียสมากกว่าอิเล็กตรอนในระดับพลังงานสูง
4.ระดับพลังงานต่ำ ๆ จะอยู่ห่างกัน และเมื่อสูงขึ้นจะอยู่ชิดกันมากขึ้น กล่าวคือ ยิ่งระดับพลังงานสูงขึ้นจะยิ่งอยู่ชิดกันมากขึ้น
5.เส้นสเปกตรัมของธาตุ แสดงให้เห็นถึงพลังงานที่อิเล็กตรอนคายออกมาเมื่อเปลี่ยนจากระดับพลังงานสูงมาสู่ระดับพลังงานที่ต่ำกว่า