
先程の説明で、水素分子や水分子の構造は説明出来るのですが、その理屈では説明ができない分子がたくさんあります。(その方が多いかも(^^;))
その一番分かり易い物が、メタンCH4でしょう。
メタンにも含まれる炭素は、L殻に4個の電子が入っています。
ですから単純に考えると、2sに二個、三個の2pには、1個、1個、0個の電子が入るはずです。が、それではメタン分子ができる説明ができない!
ですから、そういう状態にはなっていないんですね。
ここで、こんな事を考えて下さい。
赤色の絵の具と青色の絵の具を混ぜると、どうなりますか?
そうですね、紫色ができます。
赤と青が混じると、性質が違う紫が生じます。
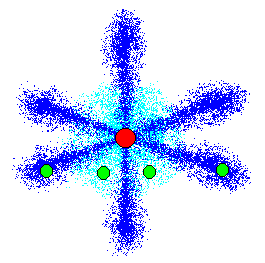
実は炭素のL殻でも、似たような事が起きています。
2s軌道と3個の2p軌道が合体して溶け合って、「sp3混成軌道」という新しい軌道が4つできています。
(sp3という名前は、s軌道が1個と、p軌道が3個合体して、混じっているからです)
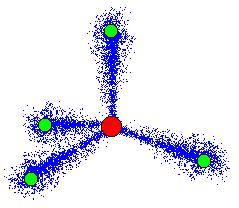
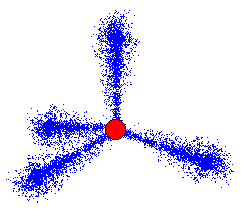
電子はsp3に1個ずつ入っています。
これに水素原子が四つくっつく訳ですね。
水素の1s軌道と、炭素のsp3が合体して混じり合います。
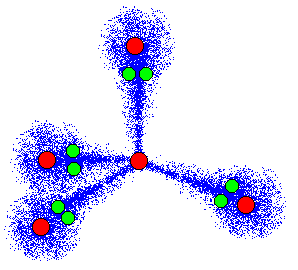
こう考えると、メタンが正四面体構造になる事が分かります。事実、メタンは実験によって、正四面体構造を採る事が分かっていますので、うまく説明ができる訳です。
これで多くの分子が説明出来ます。
例えば、アンモニアNH3はこう説明出来ます。
窒素のL殻は電子を5つ持っていますね。
そこで、4つのsp3混成軌道に、2個、1個、1個、1個の電子が入ります。
ですから、一つの軌道は、既に満員になっているので、不対電子になります。
で、残っているsp3に、水素が合体して、アンモニアになります。
ですから四面体ですが、ちょっとひしゃげた(高さの低い)四面体になります。
でも、これで全ての分子が説明出来る訳ではないんです。
特に二重結合が入ると、これでは説明出来ない場合がでてきます。
次では、その説明をしましょう。