 |
||||
| sel | + | eau | = | eau salée |
| soluté | + | solvant | = | solution |
Rappelons que la matière est constituée de tout ce
qui a une masse et qui occupe un espace.
Les scientifiques classent la matière en 2 catégories:
les substances pures et les mélanges. (Voir aussi comment séparer des mélanges)
 |
||||
| sel | + | eau | = | eau salée |
| soluté | + | solvant | = | solution |
|
Etat physique de la solution |
Etat du soluté |
Etat du solvant |
|
|
gazeux |
gaz |
gaz |
air |
|
liquide |
gaz |
vapeur d'eau dans l'air | |
|
solide |
gaz |
neige carbonique dans l'air | |
|
liquide |
gaz |
liquide |
oxygène dans l'eau |
|
liquide |
liquide |
alcool dans l'eau |
|
|
solide |
liquide |
sel dans l'eau | |
|
solide |
gaz |
solide |
hydrogène dans palladium |
|
liquide |
solide |
mercure dans or | |
|
solide |
solide |
cuivre dans or |
Remarque : Les alliages sont des solutions solides de deux ou
plusieurs éléments, généralement des
métaux.
Le mot amalgame désigne plus
spécialement les alliages contenant du mercure et d'autres
métaux.
Comparaison entre mélanges et substances pures
|
Mélange |
Composés |
|
Composition variable: deux ou |
Composition fixe: tous les |
|
Constituants séparables |
Constituants séparables par |
|
Changement
d'état couvrant |
Changement d'état à température fixe (si la pression reste constante). |
CALCUL DE LA
CONCENTRATION DES SOLUTIONS
(inspiré largement par http://home.ican.net/~samsara/)
La concentration molaire d'un constituant (A)
ou MOLARITÉ est le quotient du nombre de moles (N) par le volume (V).
| Molarité de A = [A] = C = N (mol)/V (L) |
Unité SI:
mol.m-3. Unité usuelle
: mol. L-1
Le symbole de la concentration du constituant
«A» est CA ou [A] .
Ainsi une solution de NaOH (masse molaire = 40g) qui contient 4
g de soluté par litre de solution a une molarité de
4/40.1-1 ou 0,1M.
2. AUTRES MESURES POUR EXPRIMER LA CONCENTRATION
Il est souvent pratique au laboratoire
d'utiliser d'autres mesures pour exprimer la concentration
d'une solution :
| Le titre (T)
il se calcule en utilisant la masse du soluté (m)
exprimée en grammes divisée par le volume
de la solution (V) exprimé en litres. Ainsi une solution qui contient quinze grammes de soluté par litre de solution a un titre ou une concentration de 15 g/litre |
T = m/V |
| La molalité (ML) ; c'est le nombre de moles de soluté (N) par kilogramme de solvant. | ML = N(mol)/mSolvant |
| Le pourcentage en masse (%), c'est le nombre de grammes de soluté dans cent grammes de solution. On l'obtient en divisant la masse du soluté par la masse de la solution et en multipliant par cent . | Pm = mSoluté/mSolvant x 100 |
| Le pourcentage en volume, c'est le nombre de millitres de soluté dans cent millilitres de solution. On l'obtient en divisant le volume du soluté (mL) par le volume de la solution (mL) et en multipliant par cent . | PV = VSoluté/VSolvant x 100 |
| La normalité, c'est le nombre d'équivalents-grammes par litre de solution. Un équivalent-gramme d'acide est la fraction de mole qui correspond à un proton (H+ ou H3O +) (une mole pour HCl, une demi-mole pour H2SO4). Un équivalent-gramme de base est la fraction de mole qui correspond à un ion hydroxyde OH- [une mole pour NaOH, une demi-mole pour Ca(OH)2]. Une solution décinormale d'acide chlorhydrique (0,1 N) contient 3,65 g de chlorure d'hydrogène par litre de solution. | N = NE/V |
3. RELATION ENTRE NORMALITÉ ET MOLARITÉ
Pour les monoacides et les monobases on a N = C ou N = M. Pour les diacides (dibases), les triacides (tribases) on a: N=2M; N=3M.
1. À un litre d'une solution de MgCl2, dont la concentration est 2 M (2 mol/L), on ajoute de l'eau pour que le volume final soit de 5 L. Calculer les concentrations en moles d'ions Mg 2+ et Cl -.
MgCl2 se dissocie pour donner les
ions Mg 2+ et Cl -, selon
l'équation : MgCl2 (s)  Mg 2+(aq) + 2
Cl -(aq). Le litre de solution de chlorure de
magnésium (2 mol/L) contient deux moles d'ions
magnésium et quatre moles d'ions chlorure.
Après dilution, le volume de la solution est de cinq
litres. Les concentrations en moles d'ions
Mg 2+ et Cl - sont:
Mg 2+(aq) + 2
Cl -(aq). Le litre de solution de chlorure de
magnésium (2 mol/L) contient deux moles d'ions
magnésium et quatre moles d'ions chlorure.
Après dilution, le volume de la solution est de cinq
litres. Les concentrations en moles d'ions
Mg 2+ et Cl - sont:
| [Mg 2+] = 2 mol/5L = 0,4 mol/L et [Cl -] = 4 mol/5L = 0,8 mol/L |
 Na + (aq) + Cl - (aq)
Na + (aq) + Cl - (aq) Mg 2+(aq) + 2 Cl -
(aq)
Mg 2+(aq) + 2 Cl -
(aq) K + (aq) + Cl - (aq)
K + (aq) + Cl - (aq)
- Les trois litres de solution de chlorure de
sodium (1 mol/L) contiennent trois moles d'ions sodium et trois
moles d'ions chlore.
- Les quatre litres de solution de chlorure de magnésium
(0,5 mol/L) contiennent deux moles d'ions magnésium et
quatre moles d'ions chlore.
- Les trois litres de solution de chlorure de potassium (2
mol/L) contiennent six moles d'ions potassium et six moles
d'ions chlore.
Le volume total de la solution est de dix litres et le nombre
total de moles d'ions chlore est de treize.
Les concentrations des différents ions
sont donc:
| [Na +] = 3 mol/10 L = 0,3 mol/L | [Mg 2+ = 2 mol/10 L = 0,2 mol/L |
| [K +] = 6 mol/10 L = 0,6 mol/L | [Cl - = 13 mol/10L = 1,3 mol/L |
|
Lorsqu'on dilue une solution aqueuse, on ajoute de
l'eau sans modifier la quantité de
soluté. Le nombre de moles de soluté
reste constant et le volume varie. Observons
l'exemple ci-contre : lorsqu'on se
déplace de gauche à droite, la
concentration diminue. D'une façon
générale, supposons que le volume initial
de la solution soit «Vi», et
que sa concentration soit
«Ci». Après addition
d'eau, le nouveau volume est «Vi
» et la nouvelle concentration sera
«Cf». Comme le nombre de moles
est constant, nous pouvons écrire la relation
suivante : Ci : Concentration de la solution
initiale. |
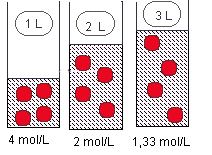 4 mol/L x 1 L = 4/3 mol/L x 3 L 4 mol/L x 1 L = 2 mol/L x 2 L |
|
Certains solutés, comme les acides forts, par exemple, sont vendus aux écoles ou aux laboratoires sous forme de solutions très concentrées appelées "aolutions-mères" ou initiales. Les concentrations sont données en molaires (M ou mol/V), toutefois, le volume peut être exprimé en litres (L) ou en millilitres (ml) à condition que le deux volumes, Vi et Vf soient dans les mêmes unités. |
|