

Les substances les plus courantes dans la nature sont des mélanges. L'eau salée, par exemple, est un mélange d'eau et de sel tandis que l'air est un mélange de divers gaz. Il arrive très souvent qu'une substance doive être purifiée avant d'être utilisée. Ainsi, l'eau de mer n'est pas potable mais l'eau distillée l'est.
La purification de divers mélanges fait appel à des techniques de purification/séparation variées. Cela nous procure donc l'occasion de réaliser de petites expériences au laboratoire.
Dans un mélanges, les composants retiennent leur propriétés physiques propres. C'est en utilisant ces différences dans les propriétés physiques que les composants peuvent être isolés. Une solution salée contient des éléments dont les points d'ébullition sont très différents: sel, NaCl (point d'ébullition 1413 °C) et eau, H2O (100 °C). Il s'ensuit qu'ils peuvent être séparés par évaporation, distillation simple ou distillation fractionnée. Cependant, avant de choisir une méthode appropriée, vous devez bien connaître les propriétés individuelles des composants du mélange.
| Méthodes de séparation | Matériel requis | Différences dans les propriétés physiques des composants sur lesquelles repose la technique de séparation | Exemple pratique |
| Filtration | Béchers, entonnoir, papier filtre | Dimension des particules | Eau (petites particules) et sable (grosses particules) |
| Décantation | Béchers, tige de verre | Grande différence de densité | Eau (faible densité) et sable (forte densité) |
| Centrifugation | Centrifugeuse avec tubes | Faible différence de densité | Eau (faible densité) et farine (densité un peu supérieure) |
| Séparation | Ampoule à décanter, bécher | Densité différente de liquides non miscibles | Eau (forte densité) et huile d'arachide (faible densité) |
| Évaporation | Bec Bunsen, capsule d'évaporation, verre de montre | Grande différence entre les points d'ébullition | Eau (100 °C) et sel (1413 °C) |
| Distillation simple | Bec Bunsen, eau courante, réfrigérant, thermomètre | Grande différence entre les points d'ébullition | Eau (100 °C) et sel (1413 °C) |
| Distillation fractionnnée | Bec Bunsen, eau courante, réfrigérant, thermomètre, colonne de fractionnement | Faible différence entre les points d'ébullition | Alcool (78 °C) et eau (100 °C) |
| Sublimation | capsule d'évaporation, entonnoir, tube à essai | Un solide qui se sublime et un autre qui ne le fait pas | Iode (187 °C) et sable |
| Cristallisation | Béchers, thermomètre, papier-filtre | Solubilité | Sucre (très soluble dans l'eau chaude, faible solubilité dans l'eau froide) |
| Chromatographie sur papier | Papier filtre, solvant (éluant) convenable | Solubilité dans le solvant | Les colorants composant une couleur sont plus ou moins solubles dans le solvant |
| Méthode | Illustration |
Les trous d'un papier filtre sont si petits qu'ils ne laissent passer aucune particule plus grosse qu'une bactérie. Les grosses particules retenues sur le papier filtre constituent le résidu tandis que ce qui traverse le filtre s'appelle le filtrat. |
|
Comme la terre est plus dense que l'eau, elle se déposera par gravité au fond d'un bécher après un certain temps de repos. La plus grande partie de l'eau pourra ensuite être versée délicatement dans un autre récipient. La décantation n'est qu'une étape préliminaire car elle ne peut purifier complètement l'eau. |
Cliquer une fois sur l'image pour faire passer 10 minutes. Cliquer deux fois sur l'image pour faire passer 1 heure ! |
Bien que la boue soit plus dense que l'eau, la différence est si faible qu'elle ne se dépose pas par elle-même par gravité. La centrifugeuse crée une gravité plus grande qu'en réalité. Si l'on met l'eau boueuse dans une centrifugeuse et qu'on actionne cette dernière, les particules de boue finiront par se déposer au fond du tube. |
Passer avec la souris sur l'image pour tourner la manivelle !
Résultat au bout de 20 secondes : |
L'ampoule à décanter est utilisée pour séparer deux liquides non miscibles dont les densités sont différentes. |
|
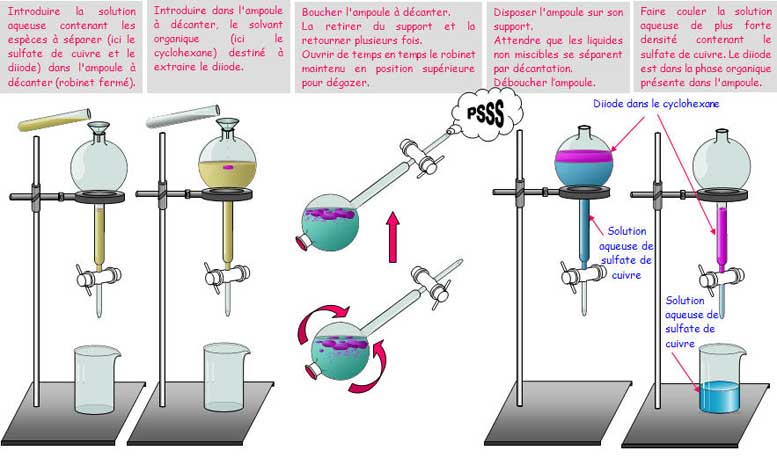 |
|
Comme le sel a un point d'ébullition beaucoup plus élevé (1413 °C) que celui de l'eau (100 °C), seule cette dernière s'évaporera lors du chauffage de la solution salée et il ne restera que le sel. Voir aussi Cristallisation ci-dessous. |
|
La distillation ressemble à l'évaporation. La seule différence est que la vapeur est récoltée après condensation. Le bulbe du thermomètre est disposé tout près du tube à dégagement pour mesurer la température de la vapeur à condenser. Le liquide condensé est appelé distillat. D'habitude on ajoute au ballon de petits morceaux de pierre ponce pour réguler l'ébullition. |
|
Par simple distillation, on ne peut séparer de façon satisfaisante un mélange d'eau et d'éthanol. Cela s'explique par la différence relativement faible entre leurs points d'ébullition (100 °C pour l'eau et 78 °C pour l'éthanol). Quand le mélange est chauffé à 78 °C, l'eau et l'alcool s'évaporent tous deux. Cependant, la présence de la colonne de fractionnement fournit des surfaces suffisamment froides pour que le composant le moins volatil de la vapeur, l'eau, s'y condense. Finalement, en théorie, seul le composant le plus volatil, l'alcool, atteint le haut de la colonne et passe dans le réfrigérant. En réalité, de la vapeur d'eau réussit toujours à accompagner l'alcool. En recommençant plusieurs fois à partit du distillat, on arrivera cependant à des concentrations assez fortes en alcool. |
|
Quelques solides passent directement par chauffage à l'état gazeux sans passer par la phase liquide. Cette sorte de solide peut être séparée d'un mélange en chauffant ce dernier au-delà du point de sublimation et en fournissant une surface froide pour la sublimation (condensation) inverse. Si l'on chauffe un mélange de sable et de diiode, le diiode se sublimera à 187 °C et pourra être récolté sur une surface relativement froide. Le chlorure d'ammonium et le chlorure de fer(III) sont d'autres exemples où cette techique peut être employée. |
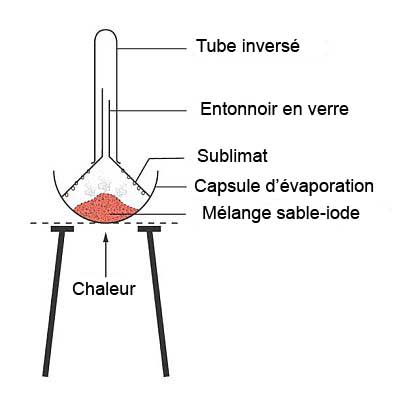 ; ; |
La quantité de soluté pouvant être dissoute dépend de la quantité de solvant et de sa température. En règle générale, plus haute est la température et plus grand le volume de solvant, plus de soluté peut être dissous. Une solution qui ne peut plus dissoudre de soluté à une certaine température est dite saturée. Si l'on refroidit une solution saturée ou si on l'évapore, elle ne sera plus capable de garder le montant originel de soluté et une partie de celui-ci se cristallisera hors de la solution. Les impuretés cependant resteront dans la solution et ne se retrouveront pas dans les cristaux qui seront purs. Remarquons que plus la vitesse de cristallisation est lente et plus les cristaux seront gros. |
|
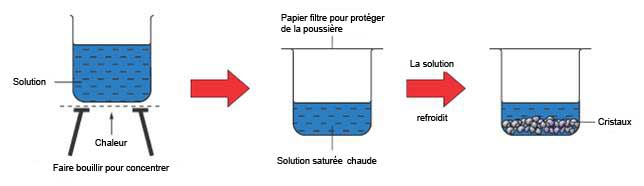 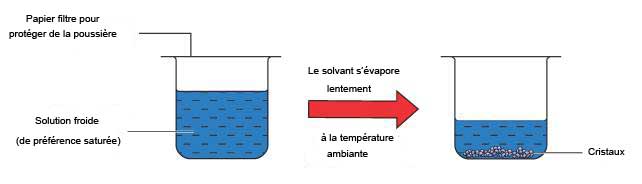 |
|
On peut utiliser la chromatographie sur papier pour séparer un mélange de colorants. Comme différents colorants ont des solubilités différentes dans un certain solvant, ils se déplaceront à des vitesses différentes dans le solvant qui monte par capillarité. Le chromatogramme obtenu peut servir à identifier les composants d'un mélange. Le relevé de l'empreinte ADN est une technique qui utilise la chromatographie. |
|
©2003-2009 I. Noels