 |
CALOR de DISOLUCIÓN
INTRODUCCIÓN
Desde el punto de
vista de la ingeniería química resulta de gran importancia saber, que gran
cantidad de
las
industrias químicas utilizan ampliamente la transferencia de calor en sus
procesos. Pero si
bien es cierto que la Termoquímica
establece las bases teóricas del manejo del calor
en las reacciones químicas,
desde el punto de vista experimental,
la
calorimetría
nos permite
qué
tanto calor como una forma de la energía
absorbida o desprendida
está presente en una reacción. Determinar esta
energía presente en una reacción es
posible
bajo dos condiciones termodinámicas; ya sea a presión constante, o a volumen constante.
Para determinar
experimentalmente en un calorímetro, la
energía absorbida o desprendida de una reacción
como es el caso particular del calor de disolución del carbonato de sodio, es conveniente primeramente plantear una ecuación del balance
general de calor en el sistema, es decir:
.
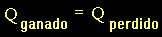 (1)
(1)
.
En esta ecuación es necesario distinguir, quién gana
energía en el sistema y quién la cede. En el caso
particular que nos plantea el proyecto experimental, la reacción de
disolución, resulta de la forma:
A
(s) + B (ac) AB (ac)
+ Q disolución (2)
.
notamos que al disolverse el compuesto
"A" en el disolvente "B"; esta reacción
de disolución es la parte del sistema que cede
el calor, y
por lo tanto la ecuación (1)
se transforma en:
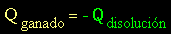 (3) (3)
.
ahora, si analizamos "Qganado"
éste debe corresponder a la cantidad de calor que absorbe la
parte del
sistema calorímetro-agua contenida y además el soluto "A"
que se agrega para realizar la reacción de disolución, por lo tanto tenemos
que:
.
 (4) (4)
Si el proceso se realiza a "P
= cte." entonces:
 (5) (5)
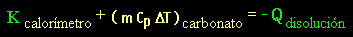 (6) (6)
Aquí definimos los valores de "m
Cp ΔT" como "K", la
constante del calorímetro, que es
la cantidad de calor que absorbe el calorímetro por grado de temperatura.
El término siguiente corresponde al calor que absorbe el soluto (Na2CO3) cuando
a éste se
le incrementa la temperatura desde la temperatura ambiente hasta una
temperatura mayor (a la
temperatura de la transición
hidrato-sal anhidra, en este caso particular aproximadamente
35ºC). Por lo
tanto la ecuación (4) se transforma en la ecuación
(6), la cual nos permite plantear el balance de calor
en el calorímetro, para la reacción
de disolución del carbonato de sodio (A), y así
determinar el calor de disolución.
OBJETIVO
El objetivo principal que se pretende lograr
en éste experimento es que el alumno determine de manera empírica
la entalpía de disolución de una sustancia en un medio
acuoso,
así como el porcentaje de error del valor experimental.
Para ello se introducirá al alumno en el manejo e interpretación de la termodinámica denominada calorimetría y a través de ella
familiarizar al estudiante con la determinación experimental de
los cambios energéticos y la forma de cuantificarlos.
Empleando para este fin un calorímetro construido por
ellos mismos
teniendo en consideración los mecanismos de transmisión del calor para su diseño
y llevando a cabo
la determinación de la constante del mismo así como;
algunas reacciones sencillas que permitan al estudiante cuantificar los cambios
de la entalpía de un sistema.
JUSTIFICACIÓN
Este proyecto experimental tiene como finalidad que el alumno aplique los
conocimientos adquiridos en la ciencia de la química, en la parte correspondiente a calorimetría,
y para servir como un antecedente en las asignaturas de fisicoquímica, en lo referente a
termoquímica y como una introducción a la de Balance de Calor. A la obtención de series de valores reales obtenidos
experimentalmente para su aplicación en las ecuaciones del
calor. De igual forma se pretende que el alumno sea capaz de utilizar las
gráficas obtenidas y determinar dicho fenómeno real empleado para tal fin.
PROYECTO EXPERIMENTAL
Determinación
del Calor de Disolución del carbonato de sodio,
llevando primeramente el sistema a un equilibrio térmico para
posteriormente determinar la variación de la entalpía como consecuencia de
la disolución de la sal en cuestión.
El diseño de experimento a realizar, considera, al
menos, los siguientes puntos (ver también la sección "Cómo
elaborar
un
Proyecto
de
Investigación", del portal):
-
Realice una introducción acerca del tópico
de calorimetría, "Calor de disolución" y aplíquela al caso de estudio de este experimento.
-
Haga una breve exposición acerca de qué va a medir y como lo hará.
-
Infórmese de los detalles del arreglo experimental, explique la función de
cada una de sus partes y presente un esquema detallado del armado de éste.
Presente un listado del material que se requiere en la sesión experimental.
-
Calcule la preparación de las soluciones requeridas y explique como las
preparará durante la sesión experimental.
-
Analice y discuta la ecuación para calcular el calor de
disolución. ¿Por qué se utiliza esta?
-
Encuentre la información de los calores específicos
de las especies que participan en la reacción.
-
Adelante el tratamiento y las ecuaciones que le permitirán desarrollar el
análisis de datos.
DISEÑO EXPERIMENTAL
MATERIALES REACTIVOS
|
Termómetro |
Agua (H2O) |
|
Vasos de precipitados |
Carbonato de sodio Na2CO3 |
|
Soporte universal |
|
|
Bureta
Pinzas para bureta |
|
|
Placa de agitación y
calentamiento |
|
|
Embudos de tallo corto |
|
METODOLOGÍA:
- Armar el sistema
- Calentar el agua (75 mL.) para la disolución por encima de los
35ºC
- Agregar el agua al calorímetro.
- Agitar el agua para estabilizar térmicamente el sistema,
leer y anotar en espacios periódicos de tiempo las temperaturas.
- Al momento de lograr la estabilidad térmica del sistema,
determinar la temperatura ambiente y añadir rápidamente al calorímetro la
muestra de sal, agitando el sistema y determinando las temperaturas en el
calorímetro en lapsos específicos de tiempo.
- Determinar la temperatura del sistema hasta lograr el
equilibrio térmico, y graficar los datos, esta línea se determinará con
datos de temperatura de aproximadamente diez minutos.
|
Varios son los factores que
deben tomarse en consideración, entre las más importantes se encuentran los
siguientes: |
1.-
Calibrar previamente el calorímetro para evitar los errores en la
determinación de la entalpía de la disolución del carbonato de sodio.
2.- Cuando al agua fría se añade una sal
anhidra, una parte considerable del sólido generalmente se deposita
inmediatamente formando una masa muy dura de hidrato, que luego se disuelve
muy lentamente. Para salvar esta
dificultad y medir este calor de disolución en un calorímetro, la
temperatura del agua deberá calentarse por encima de la temperatura
de la transición hidrato-sal anhidra (en este caso particularmente aprox. 35ºC).
3.-
En este experimento el carbonato de sodio debe utilizarse
anhidro. El procedimiento para deshidratar
el carbonato de sodio consiste en calentarlo a una temperatura de 150ºC por
espacio de 30 minutos.
4.- Se propone determinar el calor de
disolución del carbonato de sodio (Na2CO3),
no confundir con el
bicarbonato de sodio (NaHCO3)
REFERENCIAS
“El ΔH de
disolución del carbonato de sodio (Na2CO3)
resulta de -6.90 Kcal. / mol” (1)
 Bibliografía
básica: Bibliografía
básica:
| |
-
Palmer,
W. G. "Química Física Experimental". EUDEBA,
Buenos Aires, 1966
-
Burmistrova,
O.A., "Prácticas de Química Física", Editorial MIR, Moscú
-
R.
Chang, "Química", McGraw-Hill. 4ª Edición. México, 1992, pp. 1052.
-
T. L.
Brown, H. E. Le Way y B. E. Bursten. "Química La ciencia central", 5ª.
Edición, Editorial Prentice-Hall Hispanoamericana S.A., México, 1992,
pp. 1159.
-
Zarco,
R. E. "Seguridad en laboratorios", Ed. Trillas, México, 1990, pp. 146.
-
"The
Merck Index", 8a. Stecher, P.G., Merck Co., Inc., Rahway, N.J., USA.,
1968.
-
J.W. Dawson, "Manual de Laboratorio de Química", Ed. Interamericana, México, 1980.
-
George Hess,
"Química General Experimental", Edit. CECSA, España, 1982.
-
P.
W. Atkins. "Química Moléculas, materia, cambio", Edit. Omega. Barcelona,
1998, pp. 910
-
Langes Handbook, Pág.
9-25, Tabla 9 - 1.
|
 Bibliografía
: Bibliografía
:
| |
-
Fogler, H. S., Elements of Chemical Reaction
Engineering , Prentice-Hall International Editions, 1992.
-
Jesús Blanco-Ricardo Linarte ,
Catálisis. Fundamentos y aplicaciones industriales. Ed. Trillas 1976.
|
 Web Bibliografía
básica: Web Bibliografía
básica:
|
|