


 |
CALORIMETRÍA
Las
industrias de procesos químicos utilizan ampliamente la transferencia de calor
como una forma de la energía. El propósito de este planteamiento es analizar de
forma muy breve las bases de la
Termoquímica como una solución a problemas
de transferencia de calor en dichos procesos.
Cuando se busca
saber
calor como una forma de la energía
absorbida o desprendida
está presente en una reacción, es necesario recurrir a la
,
ésta como
resultado de la
al estudio de las reacciones químicas centra su principal interés
en la determinación de la energía en las
reacciones, lo cual resulta de particular
importancia desde el punto de vista experimental. Determinar esta
energía absorbida o desprendida en una reacción es
posible
bajo dos condiciones termodinámicas; ya sea a presión constante, que es cuando ocurre
en un reactor abierto al ambiente o a volumen constante cuando sucede
en el interior de un reactor que está cerrado.
El significado de los casos anteriores
implica que de acuerdo a la primera ley de la termodinámica la variación
térmica que ocurre dentro de un rector y de acuerdo a ella, cualquier
calor agregado al sistema irá a incrementar la energía interna, y a
realizar un trabajo externo es decir:
 (1) (1)
definiéndose a:
w =
pdV (como la función trabajo), si
dV = 0
(el volumen es constante) no se
realiza trabajo, por lo tanto la segunda integral resulta cero, y donde "d"
representa una diferencial inexacta. Además, "E"
es la energía interna del sistema, "V"
su volumen, "p" la presión
y "q" el calor presente en el proceso.
En la ecuación (1) si se determina que "V"
es constante, el calor "Qv",
es el calor total presente en el proceso, y por tanto igual a la variación
de la energía interna, o sea:
 (2) (2)
lo que nos indica que a volumen constante,
cualquier cambio térmico que tiene lugar en un sistema reaccionante se debe
únicamente a la diferencia entre la suma de las energías internas de los
productos y la correspondiente a los reactivos.
Para estudiar los procesos a presión
constante es conveniente definir la función termodinámica "H", denominada Entalpía,
tal que:
 (3) (3)
y diferenciando la ecuación anterior tenemos:
 (4) (4)
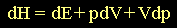 (5) (5)
Sustituyendo la ecuación

en (5) es posible argumentar que:
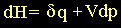 (6) (6)
Por lo tanto si el proceso es a presión
constante o isobárico entonces;
el calor "Qp" presente en la
reacción es igual a la variación de
entalpía, o sea:
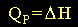 (7)
(7)
esto es que: a presión constante, no solo hay
variación de energía interna, sino además un trabajo que modifica la
proporción de calor observada en el reactor a volumen constante, lo que
finalmente se traduce como una variación de las entalpías entre los
productos y reactivos.
Las expresiones (2) y (7) son de gran importancia, pues
resulta posible con estas expresiones definir procesos bajo condiciones
termodinámicas de; volumen o presión constante, determinar el calor utilizando funciones de
estado como son la energía interna y la entalpía.
La capacidad calorífica puede ser definida de
acuerdo a la siguiente expresión:
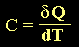 (8) (8)
donde "T" es la temperatura absoluta
y "n" el número de moles. En esta forma, y
sustituyendo con las ecuaciones (2) y (7), tenemos las expresiones siguientes para las
capacidades caloríficas a volumen y/o
presión constante:
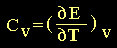 (9)
(9)
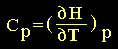 (10) (10)
De esta forma, el calor que se requiere para cambiar la
temperatura de una muestra de "n" moles de una especie será:
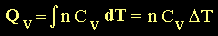 (11) (11)
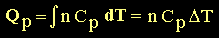 (12) (12)
Las ecuaciones (11) y (12) tienen
expresiones análogas cuando se define la capacidad calorífica de una muestra
"m" de unidad de masa.
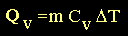 (13) (13)
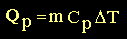 (14) (14)
En virtud de que una reacción química es un proceso
termodinámico, ésta se puede representar esquemáticamente de la siguiente forma:
aA + bB + ... → cC + dD + ...
(15)
donde "A", "B",
"C" y "D" son
átomos, moléculas, iones, radicales o cualquier especie química, mientras
que "a", "b", "c" y
"d" son los respectivos coeficientes
estequiométricos que describen las proporciones en que intervienen las
especies en la reacción. Si el proceso ocurre a presión constante y a una
temperatura "T" específica, el calor de la reacción corresponde a la
variación de entalpía correspondiente. Como ésta además es una función de
estado, es posible escribir:
 (16) (16)
por lo que, de la ecuación (15)
tenemos:
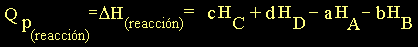 (17) (17)
donde "Hi"
es la entalpía molar del componente "i"
cualquiera.
Si se define la
reacción de formación de un compuesto, como aquélla que expresa la
formación de éste a partir de sus elementos. El calor de formación será, por
lo tanto, el calor correspondiente a esa reacción. La entalpía de formación
estándar de un compuesto es definida como el calor de reacción
correspondiente, determinado a las condiciones estándar de presión, igual a
1atmósfera y a la temperatura de
25°C. Es fácil observar desde la
definición que las entalpías de formación de los elementos son cero. Por
otra parte, considerando la relación (16), es posible escribir la expresión:
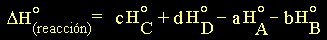 (18) (18)
donde "H°i" es la
entalpía estándar del compuesto "i" que ha sido determinada
experimentalmente y se encuentra publicada en Tablas para la mayor parte de
los compuestos conocidos.
Utilizando los valores correspondientes de
"H°i" para él componente en cuestión y la ecuación (18) se determina la entalpía
estándar de una reacción (a 25°C y 1 atmósfera).
Como en general la
variación de la entalpía con la presión es muy pequeña ésta puede ser
despreciada.
Si se quiere conocer la variación de entalpía con
respecto a la temperatura, por ejemplo a cualquiera "T"
diferente a 25°C, es
necesario utilizar la ecuación de Kirchhoff que
permite calcular la diferencia de variación de entalpía entre dos
temperaturas "T1" y "T2" utilizando los
calores específicos "Cp(i)" de los compuestos "i". Para ello
es necesario derivar a presión constante y con respecto a la temperatura,
a la ecuación (16) obteniendo:
 (19) (19)
o sea:
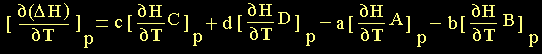 (20) (20)
como se definió anteriormente:
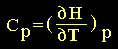
entonces:
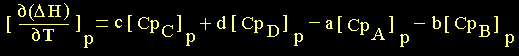 (21) (21)
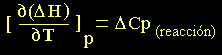 (22) (22)
La integración
de la ecuación anterior depende de si el "Cp"
es constante o
función de la temperatura. Cuando el "Cp"
es constante, la integración entre las dos
temperaturas, T1 y T2, nos da:
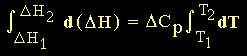 (23) (23)
si la "T1"
es la temperatura estándar de
298°K
y una temperatura cualquiera "T",
se obtiene la expresión:
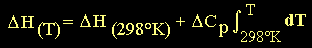 (24) (24)
denominada ecuación de
Kirchoff para la entalpía.
 Bibliografía
básica: Bibliografía
básica:
| |
-
S.
H. Maron y C. F. Prutton, Fundamentos de Fisicoquímica, Edit. Limusa
Wiley, S. A., México, 1968, pp. 900
-
Ya
Guerasimov,
Curso de Química Física, !er. Tomo, 3a. Edición, Edit. MIR. Moscú, 1980, pp.
636.
-
T.L.
Brown, H.E. Le Way y B.E. Bursten. Química La ciencia central, 5ª.
Edición, Editorial Prentice-Hall Hispanoamericana S.A., México, 1992,
pp. 1159.
-
Charles
E. Mortimer, Química, Ed. Iberoamérica, S.A., México, 1983.
|
 Bibliografía
: Bibliografía
:
| |
-
Alan S. Foust, Principios de operaciones Unitarias, 3a.
Edición, Compañía Editorial Continental, S. A. México, 1969.
|
 Web Bibliografía
básica: Web Bibliografía
básica:
|
|