 |
LEY de HESS
Ecuaciones Termoquímicas
Las
industrias de procesos químicos utilizan ampliamente la transferencia de calor
como una forma de la energía. El propósito de este planteamiento es analizar de
forma muy breve las bases de la
Termoquímica como una solución a problemas
de transferencia de calor en dichos procesos.
Cuando se busca
saber
calor como una forma de la energía
absorbida o desprendida
está presente en una reacción, es porque
la misma juega un papel muy importante de los cambios químicos, la pregunta
obvia en este caso resulta; ¿A qué se debe esa
importancia? Se debe a que en todo cambio químico hay ruptura y formación
de nuevos enlaces químicos y para que haya esa ruptura, se requiere energía y
algunas veces en la formación de los nuevos enlaces se requiere de menor energía
para su formación y por tanto se desprende la energía sobrante, razón por la
cual, el estudio del calor y de su relación con los cambios químicos resulta tan
importante. Además de lo anterior es necesario también conocer si el proceso
depende no solo de si el cambio se efectúa a volumen o presión constante,
sino también de las cantidades de sustancia considerada, su
estado
físico, temperatura y
presión.
En virtud de que la cantidad de calor
obtenida en una reacción depende de la cantidad de sustancia que intervino
en ella, si escribimos que dos gramos de hidrógeno se queman en oxígeno para
producir agua líquida, y se desprenden 68,320 calorías, entonces cuando
incrementamos a cuatro gramos, el calor desprendido es doble y así
sucesivamente. Esto es, que en vez de especificar la cantidad producido por
gramo de sustancia para una reacción particular, es usual hacerlo de la
siguiente manera:
|
H2 |
+ |
1/2 O2 |
D |
H2O |
|
∆H = - 68,320 cal |
(1) |
una ecuación balanceada que incluye la
energía calorífica se conoce como
ecuación termoquímica. Una ecuación termoquímica puede representarse
de dos maneras. En la primera, el calor de la reacción se muestra por
separado usando el símbolo ∆H. Este término se define como cambio
de entalpía o simplemente como “calor de reacción”, (aquí
la “∆” se refiere a una diferencia, es decir se
cuantifica el cambio).
Entalpía es el contenido de de calor en forma de energía química de un
compuesto en particular. El cambio de entalpía es el cambio en el contenido
de calor en la conversión de los reactivos en productos. Por convención, un
signo negativo para ∆H corresponde a una reacción
exotérmica y un signo positivo a una reacción
endotérmica, y por lo tanto esta ecuación señala que cuando un
mol de hidrógeno reacciona con 0.5 mol de oxígeno para producir un mol de
agua se desprenden 68,320 calorías medidas a presión constante.
La segunda forma de representar una ecuación
termoquímica muestra la cantidad de energía calorífica como si fuera un
reactivo o un producto, por ejemplo:
|
H2 |
+ |
1/2 O2 |
D |
H2O |
+ |
68,320
cal |
|
|
N2 |
+ |
O2 |
+ |
756,699
cal |
D |
2 NO |
|
Si se desea indicar la interacción de dos
moles de hidrógeno con un mol de oxígeno para formar dos moles de agua, la
ecuación (1) se debe escribir multiplicando la variación de entalpía
de la misma forma en que se incrementa la estequiometría de la reacción, es
decir:
|
2H2 |
+ |
O2 |
D |
2H2O |
|
∆H = 2 (- 68,320) = - 136,640
cal |
(2) |
Sin embargo la ecuación (1)
es
incompleta en dos cuestiones bastante importante. En primer lugar, el calor
de ala reacción corresponde a la condición estándar de 25°C, lo cual debe
quedar establecido, y además se debe especificar el estado físico de los
reactivos y productos. Esto es que en la ecuación en estudio, el agua
puede estar en cualquiera de los dos estados físicos posibles, líquido o
vapor, pero el ∆H de la reacción es diferente, ya que para el agua vapor
∆H = - 57,800 caloría, es decir entre los
dos valores hay una
diferencia de 10,520 calorías, razón por la cual la ecuación
termodinámica se debe expresar de la siguiente manera:
|
2H2
(gas) |
+ |
O2
(gas) |
D |
2H2O (liq.) |
∆H
25 °C = H
H2O
(liq.) = - 136,640
cal |
(3) |
es común utilizar los símbolos
(g). (l), y (s) para designar las fases
gaseosa, líquida y
sólida, mientras que (ac) es la abreviatura de una solución
acuosa diluida.
Es importante destacar que el significado
físico de la ecuación termodinámica define la diferencia de la entalpía de
productos y reactivos, en otras palabras, para la ecuación
(1), la
entalpía de la reacción es:
|
H2 (gas) |
+ |
1/2 O2
(gas) |
D |
H2O (liq.) |
∆H 25 °C =
H productos
– H reactivos
= -
68,320 cal |
(4) |
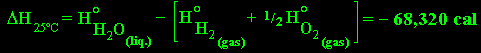 (5) (5)
Como el ∆H 25 °C en este caso
es negativo, la suma de los contenidos de calor de los reactivos debe
exceder a 68,320 calorías, y en consecuencia cuando se genera un mol de agua
líquida a partir de sus elementos constitutivos, la cantidad de calor es
desprendida. De manera contraria la descomposición de un mol de
agua líquida en sus constituyentes, la suma de los contenidos caloríficos de
los productos excede al de los reactivos en la misma cantidad y por lo tanto
es necesaria la absorción de 68,320 calorías para efectuar la
reacción
La ley de Hess,
puede enunciarse diciendo que;
“la
variación de entalpía de una reacción es el resultado de una serie de
etapas, y éste es el resultado de la suma algebraica de las variaciones
correspondientes a dichas etapas, la que a su vez esta suma, es idéntica a
la que tendría lugar por absorción o desprendimiento en una reacción que
procediera en una sola etapa”. Esta ley de Hess, resulta de
gran utilidad para estimar en forma indirecta una entalpía de reacción
desconocida, resultando factible calcular los calores de muchas reacciones
cuya medición directa no es posible o deseable realizar. En
estos cálculos las ecuaciones termoquímicas se manejan como si fueran
ecuaciones algebraicas ordinarias, sumándose, restándose y multiplicando o
dividiéndose. Si, por ejemplo, existen tres etapas I, II y III, entonces se
tiene que:
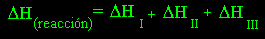 (6) (6)
La relación (6)
es evidentemente una
consecuencia directa del hecho de que la entalpía es una función de estado.
Una expresión análoga puede escribirse para la energía interna.
Para entender mejor dicha Ley de Hess.
Supongamos que se desea conocer el ∆H Reacción
de por ejemplo la siguiente reacción:
|
2 C(s) |
+ |
2 H2 (g) |
+ |
O2 (g) |
D |
CH3COOH(l) |
|
∆H 25 °C = ¿? |
(7) |
que no puede determinarse directamente.
Pero que afortunadamente se encuentran disponibles las siguientes mediciones
calorimétricas:
|
CH3COOH(l) |
+ |
2 O2 (g) |
D |
2 CO2(g) |
+ |
2 H2O (l) |
|
∆H 25 °C = - 208,340 cal |
(8) |
|
C(s) |
+ |
O2 (g) |
D |
CO2(g) |
|
∆H 25 °C = - 94,050 cal |
(9) |
|
H2(g) |
+ |
1/2 O2
(g) |
D |
H2O(l) |
|
∆H 25 °C = - 68,320 cal |
(10) |
Si se multiplican las ecuaciones (1) y
(2)
por 2 y las
sumamos, se obtiene:
|
2 |
C(s) |
+ |
2 O2 (g) |
D |
2 CO2(g) |
|
∆H 25 °C = - 188,100 cal |
|
2 |
H2(g) |
+ |
O2 (g) |
D |
2 H2O(l) |
|
∆H 25 °C = - 136,640 cal |
______________________________________________________________________________________________________________________________________________________________________________________________
|
2 C(s) |
+ |
2 H2 (g) |
+ |
3 O2 (g) |
D |
2 CO2(g) |
+ |
2 H2OH(l) |
∆H 25 °C
= -324,740 cal |
Por otro lado, si a la ecuación anterior le
restamos la ecuación (8). Al realizar esta operación algebraica
la reacción (8) cambia el sentido de la misma, además del signo
del ∆H Reacción puesto que en éste nuevo
sentido la reacción es endotérmica, por lo tanto si:
|
2 C(s) |
+ |
2 H2 (g) |
+ |
3
O2 (g)
|
D |
2 CO2(g)
|
+ |
2 H2OH(l)
|
|
∆H 25 °C
= -324,740 cal |
|
2 CO2(g)
|
+ |
2 H2O (l)
|
D |
2 O2 (g)
|
+ |
CH3COOH(l) |
|
∆H 25 °C = +208,340 cal |
___________________________________________________________________________________________________________________________________________________________________________________________________
|
2 C(s) |
+ |
2 H2 (g) |
+ |
O2 (g) |
D |
CH3COOH(l) |
|
∆H 25 °C = - 116,400 cal |
siendo este valor la cantidad de calor liberado en la reacción
(7) a
presión constante.
 Bibliografía
básica: Bibliografía
básica:
| |
-
S.
H. Maron y C. F. Prutton, Fundamentos de Fisicoquímica, Edit. Limusa
Wiley, S. A., México, 1968, pp. 900
-
T.L.
Brown, H.E. Le Way y B.E. Bursten. Química La ciencia central, 5ª.
Edición, Editorial Prentice-Hall Hispanoamericana S.A., México, 1992,
pp. 1159.
-
Crarles
E. Mortimer, Química, Ed. Iberoamérica, S.A., México, 1983.
|
 Bibliografía
: Bibliografía
:
| |
-
Alan S. Foust, Principios de operaciones Unitarias, 3a.
Edición, Compañía Editorial Continental, S. A. México, 1969.
|
 Web Bibliografía
básica: Web Bibliografía
básica:
|
|