 |
ESTEQUIOMETRÍA
INTRODUCCIÓN
Las
reacciones químicas son algo cotidiano en la naturaleza, los cambios químicos
que se producen pueden representarse por medio de una ecuación química, en la
cual los componentes
deben estar en un balance
estequiométrico, es
decir, en relaciones de proporcionalidad que respeten la ley de la conservación
de la materia.
En los procesos químicos no cambia la cantidad de materia. La masa total
de los productos es igual a la masa total de los reactivos.
Lavoisier
Sin embargo, la reacción química no es solamente un proceso
mediante el cual una serie de sustancias a las que llamamos reactivos se
transforman en productos, sino una relación estequiométrica definida, es
decir, un proceso donde se conservan las cantidades de materia y de energía.
Así entonces, una reacción química puede representarse por
medio de una ecuación química, representada con símbolos y fórmulas,
con la indicación de proporcionalidad de materia por medio de los
coeficientes estequiométricos.
La ecuación química tiene las siguientes características:
-
Es una ecuación
matemática
-
Es eléctricamente
equivalente en sus dos lados
-
Cumple la ley de la
conservación de la energía
-
Cumple la ley de la
conservación de la masa
No obstante, cuando las reacciones químicas se llevan a cabo
en el ambiente, por lo general los reactivos no están presentes en las
proporciones que indica la ecuación de la reacción. Entonces, la cantidad de
un reactivo controla la cantidad de los productos que se pueden formar, a
éste reactivo se le llama reactivo limitante.
La cantidad de producto que se formará
mediante una reacción química, puede ser calculada mediante la proporción en
que se encuentran los reactivos y productos; a éste resultado se le llama
rendimiento teórico. Así, en algunos casos sí se obtendrá la cantidad
calculada de producto (reacciones cuantitativas). Y en otros se obtiene
menos producto debido a una o más de las siguientes razones:
-
Es un reactivo impuro.
-
Se pierde mecánicamente algo de producto (por ejemplo,
porque se adhiere al recipiente).
-
Los reactivos participan en más reacciones además de la que
se desea que suceda.
El rendimiento porcentual o % de rendimiento, se
define como;
la cantidad
de producto que se forma realmente,
dividida entre la cantidad calculada del
producto que se formaría multiplicada por 100.
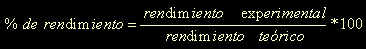
Por otra parte, las reacciones pueden ser clasificadas de
acuerdo a las características de transformación que involucran, siendo las
reacciones de síntesis y de desplazamiento las más comúnmente
observadas, y así
mismo las más utilizadas en la industria.
-
Reacciones de síntesis o
de formación de compuestos, son aquellas en que se obtiene un compuesto a
partir de dos o más sustancias.
-
Reacciones de
desplazamiento son aquellas en que un elemento remplaza a otro compuesto,
pueden dividirse en reacciones de desplazamiento simple o de doble
desplazamiento, si se reemplaza uno o dos elementos respectivamente.
En este proyecto experimental, se estudian ambos tipos de
reacciones mediante la formación de una sal (sulfato de cobre penta
hidratado),
considerando a ésta como un compuesto iónico que remplaza uno o más H+
de un ácido por otros cationes.
A la reacción que se
desea llevar a cabo se llama reacción principal, y a las reacciones no
deseadas se llaman secundarias; los productos de las reacciones
secundarias se llaman subproductos.
OBJETIVOS
Los objetivos principales de este proyecto experimental son
Inducir las leyes ponderales
que se cumplen al transformar
un metal en
diferentes compuestos hasta obtener la sal hidratada del metal seleccionado.
Y
aplicar los cálculos estequiométricos
a las diversas ecuaciones químicas del
proceso para obtener el sulfato de cobre II penta hidratado.
Para ello se introducirá al alumno en el concepto de una síntesis
química así como de los diferentes tipos de reacciones químicas y del balanceo
de las mismas a fin de determinar estequiométricamente la cantidad de producto
del proceso de síntesis.
JUSTIFICACIÓN
Este proyecto experimental tiene como finalidad que el alumno aplique los
conocimientos adquiridos en Química, en lo referente a la parte correspondiente
a estequiometría. En virtud de lo anterior se pretende que el alumno sea capaz de
balancear ecuaciones químicas e interpretar el significado cualitativo y
cuantitativo de una ecuación química balanceada al deducir las relaciones
masa/masa y masa/volumen de las ecuaciones individuales en cada ecuación
química.
A fin de la determinación de valores reales a partir de las
cantidades de productos y reactivos calculados teóricamente por ellos mismos, en
las ecuaciones que representan dicho fenómeno real empleado para tal fin.
PROYECTO EXPERIMENTAL
Obtención del sulfato de cobre II penta hidratado a partir de cierta
cantidad (en gramos)
de cobre elemental, mediante una síntesis química, para así
demostrar la ley de la conservación de la masa.
Cu0
(s) +
HNO3
(dil. 1:1)
→
Cu(NO3)2 (ac) +
NO (g)
+ H2O
(l)
Cu(NO3)2 (ac) +
NaHCO3
(ac)
→
CuCO3 (s) +
NaNO3 (ac) +
CO2 (g) +
H2O
(l)
CuCO3
(s) +
H2SO4 (dil. 1:4)
→
CuSO4 (ac) +
CO2
(g) + H2O
(l)
CuSO4 (ac) +
{1º.
– H2O} ; {2º.
+ disolvente}
→
CuSO4·5H2O(s)
Cabe destacar,
que cada una de las "operaciones unitarias" a realizar tiene un
procedimiento propio, y que de cada una de ellas, producirá distintos compuestos,
algunos no serán requeridos y por lo tanto, será necesaria la separación y
purificación de los reactivos a utilizar en la siguiente etapa.
Así entonces,
es necesario considerar algunos aspectos metodológicos que permitan la
ejecución adecuada de las reacciones, haciendo hincapié de que todo el
proceso se realiza en solución acuosa, y por lo tanto, habrá que establecer
que compuestos son solubles y cuales no, para así poder identificar a los
precipitados, compuestos disueltos, y entonces, separarlos.
DISEÑO EXPERIMENTAL
MATERIALES REACTIVOS
|
» Vaso de precipitado 100
mL.
» Vaso de precipitado 150 mL.
» Tubo de ensaye
» Pipeta volumétrica 1mL.
» Parrilla de calentamiento
» Cuerpos de ebullición
» Campana de absorción
» Soporte universal
» Arillo de metal
» Embudo de talle largo
» Papel filtro #2
» Vidrio de reloj
» Balanza analítica
» Varilla de vidrio con gendarme
|
Cobre
Ácido nítrico
Bicarbonato de sodio
Ácido sulfúrico concentrado Agua destilada |
METODOLOGÍA:
 Para la oxidación del cobre. Para la oxidación del cobre.
Cu0
(s) +
HNO3
(dil. 1:1)
→
Cu(NO3)2 (ac) +
NO (g)
+ H2O
(l)
-
Hacer reaccionar 1g. de
limadura de cobre con 1 mililitro de ácido nítrico (diluido 1:1),
en un vaso de precipitado de 100ml.
-
Acelerar el proceso,
por medio del calentamiento de la solución en “baño maría”.
Para la precipitación del carbonato
Cu(NO3)2 (ac) +
NaHCO3
(ac)
→
CuCO3 (s) +
NaNO3 (ac) +
CO2 (g) +
H2O
(l)
-
En la
solución anterior, agregar 2.6421g de carbonato ácido de sodio disuelto.
-
Hacer
reaccionar calentando indirectamente la solución y mezclando bien los
componentes.
Para la separación del carbonato de cobre y el nitrato de sodio
-
Filtrar por decantación
-
Lavar el precipitado
-
Trasvasar el precipitado
-
Dejar secar el carbonato de cobre
Para la obtención del sulfato
CuCO3
(s) +
H2SO4 (dil. 1:4)
→
CuSO4 (ac) +
CO2
(g) + H2O
(l)
-
Hacer reaccionar en un vaso
de precipitado de 100mL, el carbonato de cobre y 0.9mL de ácido
sulfúrico (dil. 1:4).
Para
la obtención del sulfato de cobre penta hidratado
CuSO4 (ac) +
{1º.
– H2O} ; {2º.
+ disolvente}
→
CuSO4·5H2O(s)
-
Calentar la solución en
baño maría, hasta alcanzar el punto de saturación.
-
Dejar reposar la solución
hasta la formación de cristales y total evaporación del líquido.
 |
Uno de los factores que se consideran más importante en esta síntesis
química es el establecimiento de
ya que la generación de óxidos de nitrógeno
y la humedad de la atmósfera torna corrosivos a estos gases, por lo
que: |
|
1.-
La primera operación unitaria del
proceso se
debe
realiza dentro de
una campana de absorción
 "Referencias
el contenido de esta sección está sujeto a cambios" "Referencias
el contenido de esta sección está sujeto a cambios"
 |
Cabe destacar, que cada una de las etapas a
realizar tiene un procedimiento propio, y que cada una de las etapas,
producirá distintos compuestos, que algunos no serán requeridos y por lo
tanto, será necesaria la separación y purificación de los reactivos a
utilizar en la siguiente etapa.
Así entonces,
es necesario considerar algunos aspectos metodológicos que permitan la
ejecución adecuada de las reacciones, haciendo hincapié de que todo el
proceso se realiza en solución acuosa, y por lo tanto, habrá que establecer
que compuestos son solubles y cuales no, para así poder identificar a los
precipitados, compuestos disueltos, y entonces, separarlos.
 Bibliografía
básica: Bibliografía
básica:
| |
-
D.
A. Skoog, "Fundamentos de Química Analítica", Reverte, Barcelona,
1988, pp. 981.
-
R.
L. Pecsok, "Métodos Modernos de Análisis Químicos", Limusa México,
1983 p. 32 a 34.
-
R.
A. Day, "Química analítica cuantitativa", Prentice-Hall, México, 1989,
pp. 841.
-
G. H. Ayres,
"Análisis Químico Cuantitativo", Ed. Harla, México, 1978
-
-
R. L. Pecsok,
"Métodos Modernos de Análisis Químicos", Limusa México, 1983 p. 32 a
34
-
Umland J. B. y
Bellama J. M., “Química general”, 3°ed., International Thomson,
México, 2000, Pág.. 74, 85-87, 120.
|
 Web Bibliografía
básica: Web Bibliografía
básica:
|
|