 |
CINÉTICA QUÍMICA
INTRODUCCIÓN
Cuando se busca saber qué tan rápido procede una reacción, es decir, cuánto
tiempo necesita una mezcla de reacción determinada para alcanzar el estado de
equilibrio. Es necesario definir los
factores que influyen en la velocidad de la misma, tales como:
-
La naturaleza de los reactivos.
-
La concentración de los reactivos.
-
La temperatura.
-
Catalizadores.
 Al seleccionar para su
estudio una reacción química específica a una
temperatura determinada,
los factores (1), (2), y (4) se mantienen constantes; así, la velocidad de la
reacción puede y debe estudiarse experimentalmente midiendo los
cambios de
concentración
que ocurren en un intervalo de tiempo dado. Para ello se dispone de una variedad
de técnicas para encontrar los cambios de concentración que se representan en un
intervalo de tiempo. Así, para un reactivo dado, en
el caso de una reacción específica a una
temperatura determinada, Al seleccionar para su
estudio una reacción química específica a una
temperatura determinada,
los factores (1), (2), y (4) se mantienen constantes; así, la velocidad de la
reacción puede y debe estudiarse experimentalmente midiendo los
cambios de
concentración
que ocurren en un intervalo de tiempo dado. Para ello se dispone de una variedad
de técnicas para encontrar los cambios de concentración que se representan en un
intervalo de tiempo. Así, para un reactivo dado, en
el caso de una reacción específica a una
temperatura determinada,
aA + bB + ... → cC + dD + ...
 puede encontrarse la ecuación de la velocidad
de reacción partiendo de una serie de experimentos en los que se varía
sistemáticamente la concentración del reactivo determinado, mientras que las de
los otros se mantienen constantes. La ecuación de la velocidad de la reacción es una ecuación
algebraica que relaciona la rapidez de la reacción con la concentración de uno
de los
reactivos en función del tiempo. puede encontrarse la ecuación de la velocidad
de reacción partiendo de una serie de experimentos en los que se varía
sistemáticamente la concentración del reactivo determinado, mientras que las de
los otros se mantienen constantes. La ecuación de la velocidad de la reacción es una ecuación
algebraica que relaciona la rapidez de la reacción con la concentración de uno
de los
reactivos en función del tiempo.
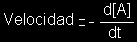
donde [A] indica el empleo de la concentración molar del
componente determinado "A", y "dt" el intervalo de tiempo.
OBJETIVO
El objetivo principal que se pretende lograr en éste experimento
es que el alumno determine la
que relaciona la velocidad de
reacción entre el KIO3 y el Na2SO3
en medio ácido variando la concentración de KIO3.
Para ello se introducirá al alumno en el manejo e interpretación
de gráficas así como en la linearización de los resultados a fin de obtener la
ecuación empírica, determinando para ello los valores de la pendiente y de la
ordenada al origen de dicha recta empleando para este fin distintos métodos
incluido el método de los mínimos cuadrados.
JUSTIFICACIÓN
Este proyecto experimental tiene como finalidad que el alumno aplique los
conocimientos adquiridos en Matemáticas, en lo referente a gráficas lineales,
potenciales, etc. A series de valores reales obtenidos experimentalmente por
ellos mismos. De igual forma se pretende que el alumno sea capaz de linealizar
las curvas obtenidas y determinar la ecuación empírica que represente dicho
fenómeno real empleado para tal fin.
PROYECTO EXPERIMENTAL
Determinación
de la Ecuación empírica del efecto del cambio en la
concentración del Yodato de potasio, o del cambio de la temperatura
en la velocidad de la reacción.
5 Na2SO3
2
KIO3
H2SO4
5 Na2SO4
K2SO4 I2
H2O
en presencia de
almidón como indicador.
DISEÑO EXPERIMENTAL
MATERIALES REACTIVOS
|
Cronómetro |
Agua destilada |
|
Etiquetas |
Solución 0.02 M de KIO3
(250 mL.) |
|
Matraces Erlenmeyer |
Solución 0.008 M de Na2SO3
(250 mL.) |
|
Vasos de precipitados |
Ácido sulfúrico
concentrado (5.0 mL.) |
|
Buretas |
Almidón soluble (3.0 g.) |
|
Soportes universales |
|
|
Pinzas para buretas |
|
|
Placa de agitación |
|
|
Agitador magnético |
|
|
Termómetro |
|
METODOLOGÍA: Para la determinación de la ecuación empírica del efecto del del
Yodato de
potasio.
El material debe estar limpio y seco.
Actividades a
desarrollar por el alumno:
Agregar 3.0 g de almidón soluble a 5 mL. de agua destilada y
agitar hasta conseguir una suspensión homogénea, mezclar con 30 mL. de agua
destilada hirviendo. ESTA SOLUCIÓN
DEBE SER PREPARADA
AL MOMENTO DE HACER
LA DETERMINACIÓN.
Enjuagar una de las buretas con 5.0 mL. de solución 0.02 M. de
Yodato de potasio, aforar la bureta y sujetarla por medio de una pinza de tres
dedos con nuez a un soporte universal. Etiquetar la bureta.
Enjuagar la otra bureta con 5.0 ml. de solución 0.008 M. de
sulfito de sodio, aforar la bureta y sujetarla por medio de una pinza de tres
dedos con nuez a un soporte universal. Etiquetar la bureta.
La ultima bureta se afora con agua destilada, se sujeta con las
pinzas de tres dedos y se etiqueta.
Se depositan en los matraces y vasos de precipitados
correspondientes los volúmenes de cada solución de acuerdo a la siguiente tabla,
etiquetando cada matraz o vaso.
|
Vaso de
precipitados “A” |
Matraz “B” |
|
Sol. 0.02 M. KIO3 (ml.) |
Agua |
Sol.
0.008 M. Na2SO3 (ml.) |
agua |
Sol. de almidón |
H2SO4 |
|
5 |
45 |
10 |
38.5 |
0.5 |
1.0 |
|
10 |
40 |
10 |
38.5 |
0.5 |
1.0 |
|
15 |
35 |
10 |
38.5 |
0.5 |
1.0 |
|
20 |
30 |
10 |
38.5 |
0.5 |
1.0 |
|
25 |
25 |
10 |
38.5 |
0.5 |
1.0 |
Colocar el vaso de precipitados “A” conteniendo el agitador
magnético sobre la placa de agitación e iniciar la agitación.
Verter el contenido del matraz “B” lo más rápidamente posible en
el vaso de precipitados “A” e iniciar el cronometraje, registrando los
resultados.
METODOLOGÍA: Para
la determinación de la ecuación empírica del efecto del en la velocidad de
la reacción.
El material debe estar limpio y seco.
Agregar 3.0 g de almidón soluble a 5 mL. de agua destilada y
agitar hasta conseguir una suspensión homogénea, mezclar con 30 mL. de agua
destilada hirviendo. ESTA SOLUCIÓN
DEBE SER PREPARADA
AL MOMENTO DE HACER
LA DETERMINACIÓN
Y SE DEBE
DE EMPLEAR FRÍA.
Enjuagar una bureta con 5.0 ml. de solución 0.02 M. de KIO3
, aforarla y sujetarla por medio de una pinza de tres dedos con nuez a
un soporte universal. Etiquetar la bureta.
Enjuagar otra bureta con 5.0 ml. de solución 0.008 M. de Na2SO3
, aforarla y sujetarla por medio de una pinza de tres dedos con nuez a
un soporte universal. Etiquetar la bureta.
La ultima bureta se afora con agua destilada, se sujeta con las
pinzas y se etiqueta.
Se depositan en cada uno de los vasos de
precipitados“A”, 5 mL. de solución
0. 02 M. de Yodato de potasio y 45 mL. de agua destilada.
Se depositan en cada uno de matraces “B”, 10 mL.
de solución 0. 008 M. de sulfito de sodio, se agregan 38. 5 mL. de agua destilada,
1. 0 mL. de ácido sulfúrico y 0. 5 mL. de solución de almidón.
Colocar un vaso de precipitados “A” y un matraz “B” en un baño
de agua a 2 °C por 3 a 5 minutos o hasta que alcance el equilibrio térmico con
el baño; vaciar el contenido del matraz “A” al vaso de precipitados “B”,
midiendo el tiempo desde el momento de mezclado hasta la aparición del color
azul intenso. Se procede de la misma manera con baños de 8 °C, 23 °C, 31 °C y 34
°C.
|
Varios son los factores que afectan la estabilidad y
concentración de las soluciones de yodo, entre las más importantes se encuentran
las siguientes:. |
1.- La volatilidad del yodo, la
cual se puede evitar guardando las soluciones en recipientes bien tapados y de
color ámbar así como en un lugar fresco ya que el CALOR AUMENTA LA VOLATILIDAD
DEL IODO.
2.- La oxidación del ioduro a iodo
en contacto con el oxígeno atmosférico, por lo cual se debe evitar la exposición
al aire en cuanto sea posible. (8) y (9).
El almidón que se usa como indicador de la reacción forma un
complejo con el yodo, pero la reacción general es más rápida que la del complejo
almidón – yodo y por lo tanto se produce yodo hasta que el sulfito se agota y en
ese momento se inicia la formación del complejo almidón – yodo (7).
Cuando se usa almidón como indicador para yodo es preciso
observar varias precauciones generales: grandes cantidades de yodo causan
coagulación de la suspensión de almidón y promueven así mismo su descomposición.
El almidón deberá emplearse a temperatura ambiente pues la sensibilidad
del punto final almidón – yodo disminuye marcadamente en soluciones a
temperaturas más altas (10).
La reacción:
5 Na2SO3 + 2 KIO3
+ H2SO4 → 5 Na2SO4 + K2SO4
+ I2 + H2O
se lleva a cabo
entre reactivos poco riesgosos, de fácil manejo y adquisición, así como de
pureza conocida, los tiempos de reacción son muy pequeños y dado que es una
reacción de las llamadas reloj, los tiempos son prácticamente iguales para
reacciones realizadas en las mismas condiciones de temperatura, presión y
concentración lo que hace que las curvas obtenidas a partir de estos datos sean
muy similares. Por otro lado el cambio de concentración que se usa como
indicador de la reacción se da repentina, intensa y uniformemente en el sistema,
con lo que se eliminan errores de observación y de apreciación.
El experimento no requiere de material o equipo sofisticado. Se
puede utilizar placa de agitación magnética. Es muy importante que la medición
de los tiempos de reacción sean registrados con cronómetro que mida hasta
centésimas de segundo ya que ellos pueden variar de una concentración a otra
hasta en fracciones de segundo, diferencias que de no poderse detectar dará
lugar a errores en la medición.
REFERENCIAS
“Casi todas las reacciones son complejas y se cree que consisten
en una serie de reacciones elementales que constituyen la reacción general,
estas reacciones elementales es lo que llamamos MECANISMO DE REACCIÓN, pero los
mecanismos de las reacciones no se conocen hasta que son deducidos a partir de
estudios EXPERIMENTALES de la reacción general. Se obtienen indicios sobre el
mecanismo para una reacción dada a partir del ESTUDIO EXPERIMENTAL de la
VELOCIDAD DE dicha REACCIÓN y otras analogías a ellas” (1)
La reacción considerada en este experimento se emplea porque
entre sus productos aparece el yodo molecular el cual es fácilmente detectable
usando almidón como indicador, con el que forma un complejo colorido ALMIDÓN –
I. Esta reacción pertenece al tipo de las llamadas reacciones reloj debido a
que es fácilmente reproducible y presenta un cambio de color repentino y
uniforme, de manera semejante a como se presenta la alarma de un reloj
despertador.
Por las ventajas antes citadas la reacción llevada a cabo entre
el sulfito de sodio y el yodato de potasio ha sido estudiada desde hace ya
varios años, encontrando referencias específicas que datan desde 1968 (Química
Moderna, P.R. Frey, 1968), y otras más recientes que se refieren a la misma
reacción (The word of chemirtry. Jones, Johnston, Netterville, 1990, Revista
Educación Química, Vol. 5 No. 2. Abril 1994).
 Bibliografía
básica: Bibliografía
básica:
| |
1. P.
W. Atkins. Química, moléculas, materia, cambio, Edit. Omega. Barcelona,
1998, pp. 910
2. R.
Chang, Química, McGraw-Hill. 4ª Edición. México, 1992, pp. 1052.
3. T.L.
Brown, H.E. Le Way y B.E. Bursten. Química La ciencia central, 5ª.
Edición, Editorial Prentice-Hall Hispanoamericana S.A., México, 1992,
pp. 1159.
4. Revista
de Educación química, Vol. 5 No. 2, Abril de 1994.
http://www.fquim.unam.mx/sitio/edquim/index.html
5. Keith
J. Lander, Cinética de Reacciones, Ed. Alambra, S.A., España, 1977.
6. Zarco,
R. E. Seguridad en laboratorios, Ed. Trillas, México, 1990, pp. 146.
7. "The
Merck Index", 8a. Stecher, P.G., Merck Co., Inc., Rahway, N.J., U.S.A.,
198, 1968.
8. J.W. Dawson, Manual de Laboratorio de Química, Ed. Interamericana, México, 1980.
9. Paul Ander y Anthony J. Sonnessa,
Principios de Química, Ed. Limusa, México, 1980.
10. George Hess,
Química General Experimental,
Ed. CECSA, España, 1982.
11. P. R. Frey,
Química Moderna, Ed. Montaner y
Simón, Barcelona, 1968.
12. Jones, Johnston y otros,
The World of Chemistry, 1980
13. Skoog Douglas,
Fundamentos de Química Analítica, Ed. Reverté, S.A., México 1993.
14. Fisher Robert,
Compendio de Análisis Químico Cuantitativo,
Ed. Interamericana, México, 1981.
15. Kenth Connors,
Curso de Análisis Farmacéutico, Ed. Reverté, Barcelona,
1981.
|
 Bibliografía
: Bibliografía
:
| |
-
Fogler, H. S., Elements of Chemical Reaction
Engineering , Prentice-Hall International Editions, 1992.
-
Boudart, M., Kinetics of Chemical
Processes., Prentice HAll, Englewood Cliffs, ( Traducción al
castellano): Alhambra, Col. Exedra, Madrid, 1974 ).
-
Jesús Blanco-Ricardo Linarte ,
Catálisis. Fundamentos y aplicaciones industriales. Ed. Trillas 1976.
|
 Web Bibliografía
básica: Web Bibliografía
básica:
|
|