 NaCl + CH3COOH
NaCl + CH3COOH
酢酸(CH3COOH)は弱酸として有名です。
しかしその塩、例えば酢酸ナトリウム(CH3COONa)は強塩基です。
塩基ですから酸と反応する事ができて、
 NaCl + CH3COOH
NaCl + CH3COOHという反応が可能です。
でも、「酢酸ナトリウムは強塩基」というのはどういう事でしょう? 教科書には大抵、そうは書いていませんね。覚えないといけないのでしょうか?
答はNOです。
「弱酸の塩は強塩基になる」というルールがあるのです。これは「共役理論」から得られる結論の一つです。
|
強酸の塩は弱塩基 強塩基の塩は弱酸
弱酸の塩は強塩基 弱塩基の塩は強酸 |
|---|
SO42-は「
H2SO4 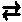 2H+ + SO42+」
を考えると、「H+を受け取って H2SO4になれる」ので、「H+を受け取る事が出来る」から塩基の仲間になる。
2H+ + SO42+」
を考えると、「H+を受け取って H2SO4になれる」ので、「H+を受け取る事が出来る」から塩基の仲間になる。
また、H2SO4が弱酸なので、平衡は右に寄っている。そのため、SO42-の方がH2SO4より安定である。
言い換えると、SO42-の「H+を受け取る力」は弱い。だから弱塩基。
二酸化炭素CO2が水に溶けて生じる炭酸H2CO3は弱酸です。
H2CO3は電離して、
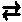 2H+ + CO32-
2H+ + CO32-
となります。
が弱酸ですから、この電離反応はあまり起きません。溶けているH2CO3の数パーセント程度がCO32-になるだけで、大多数はH2CO3のままで水中を漂っている訳です。
しかし、なぜH2CO3はH2SO4等と異なって、数パーセントしか電離しないのでしょうか?
(「弱酸だから」という答はダメだよ。その理由を聞いているんだから)
それはCO32-が不安定だからです。
NaClが水に溶けて電離し、Na+とCl-になるのは、その方が安定だからです。もし電離してイオンになるよりも、NaCl分子のまま存在する方が安定ならば、電離は起きないか、起きてもごく少数のはずです。
H2CO3は正にそのケースでして、CO32-が比較的不安定だから、電離するメリットがない訳です。
ですから、もしCO32-が水中に存在したら、不安定なので、なんとかしてH2CO3になりたいのです。
そこで、水中にあるCO32-は、通りすがりのH2OからH+を奪い、H2CO3になろうとします。
そうしますと、OH-が生じますね?ですから、CO32-は塩基なんです。しかも、CO32-は不安定で、H2CO3になろうとする力が強いのですから、OH-を生み出す力も強い訳です。
ですから結局、CO32-は強塩基と言える訳です。
また、同じ事なんですが、表現を変えますと、こうも言えますよ。
CO32-はH+を受け取る事が出来ます。ですから塩基です。しかも、CO32-は不安定だから、H+を受け取ろうとする力は強い訳です。(H2CO3になりたいからね)ですから強塩基だとも言えるでしょう。