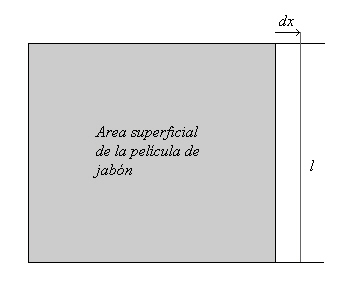

Consideremos un armazón cuadrangular de alambre, el cual consta de tres lados fijos y un lado movible de longitud l. El armazón soporta una película de agua jabonosa de área superficial s. Es posible entonces aumentar el área superficial jalando el lado movible una distancia Δx. Al mover el lado una cierta distancia efectuamos un trabajo proporcional a la distancia x recorrida:
Transformando la proporcionalidad en una igualdad:
Sabiendo que:
Si el incremento Δx es infinitesimal:
Lo cual significa que para aumentar el área superficial se requiere efectuar un trabajo. A la constante de proporcionalidad γ le llamamos tensión superficial. Las unidades de la tensión superficial corresponden a un trabajo por unidad de área (ergios/cm²) o fuerza por unidad de longitud (dinas/cm).
¿Cuál es el origen del trabajo necesario para modificar el área superficial?. Consideremos lo que ocurre con una molécula dentro de la masa de un líquido. La molécula interactúa con otras de su misma especie. Dado que la molécula se encuentra completamente rodeada por otras, el efecto promedio es una cancelación de dichas interacciones. No así en una interfase. Para formar o extender una interfase se requiere efectuar un trabajo. Para entender esto, veamos una imagen simplificada de lo que ocurre en la superficie de un líquido a nivel microscópico:
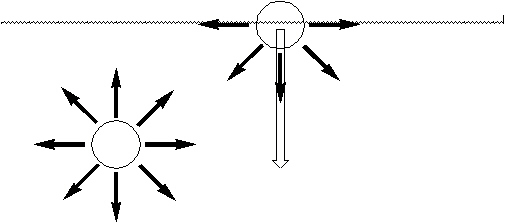
Las moléculas en una interfase entre dos líquidos A y B pueden poseer una fuerza de interacción neta. Formalmente, en una interfase podemos considerar tres casos con respecto a la intensidad y duración de las interacciones entre las moléculas de A y B:
El que las moléculas de la superficie estén tratando continuamente de internarse en la masa del líquido, significa que el número de moléculas en la superficie tiende a ser el mínimo, resultando en una área superficial mínima.
Para un tratamiento termodinámico, podemos añadir a la energía libre de Gibbs el trabajo empleado en modificar una superficie, por medio de la siguiente ecuación:
Encargado de la página: Dr. Víctor Manuel Rosas García.
e-mail:[email protected]
Facultad de Ciencias Químicas
Universidad Autónoma de Nuevo León
San Nicolás de los Garza, NL, México.