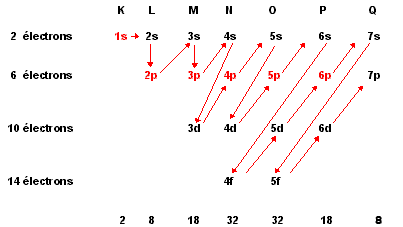
Comme nous l'avons vu lors de la description de l'atome, les couches électroniques, de K à Q, peuvent contenir un certain MAXIMUM d'électrons. Malheureusement pour notre facilité et pour des raisons qui dépassent la portée de ces pages, les électrons ne remplissent pas toujours successivement toutes les couches.
Ils remplissent plutôt des sous-couches appelées
orbitales et cela dans une
succession bien précise, comme l'indiquent les flèches
sur la figure ci-dessous.

Chacune de ces orbitales peut contenir 2 électrons ... mais il y a 1 sorte d'orbitale s (maximum 2 électrons), 3 sortes d'orbitales p (maximum de 3x2 = 6 électrons), 5 sortes d'orbitales d (maximum 10 électrons) et 7 sortes d'orbitales f (maximum 14 électrons).
Le remplissage maximum des orbitales indiquées en rouge correspond à la configuration des gaz rares.
On a donc comme configuration électronique pour le néon : 1s2 2s2 2p6 : si vous additionnez les exposants, vous arrivez bien à un total de 10. C'est le nombre total d'électrons d'un atome de néon. C'est aussi son nombre de protons donc son numéro atomique. Si maintenant vous remplissez les orbitales en suivant les flèches et en comptant les électrons, vous trouverez pour le calcium la configuration suivante :
ce qui donne bien un total de 20 électrons, correspondant à 20 protons et au numéro atomique du calcium. Si vous regardez la figure, vous verrez que cela correspond aussi à la configuration simple, par couches : 2, 8, 8, 2.
Le potasium, K, avec un électron de moins que le calcium aura comme dernière orbitale 4s1.
Le tableau périodique au début du site n'indique pour chaque élément que les orbitales qui suivent celles du gaz rare qui le précède.
Pour un tableau détaillé, cliquer ici.
L'élément 114 a été préparé pour
la première fois en 1999 par des collaborateurs du
Laboratoire pour la Recherche Nucléaire à Dubna en
Russie. Sa demi-vie de 30s correspond bien, avec une orbitale 7p
avec 2 électrons, à cet "îlot de stabilité"
prévu par les théoriciens.
Le 10 octobre 2006, la synthèse de trois atomes de
l'élément 118, ununoctium, est
finalement annoncée après avoir été
réalisée en 2002 et en 2005. Cette synthèse a
été réalisée au Flerov Laboratory of Nuclear
Reactions à Dubna, en Russie, par une équipe de
scientifiques russes du Joint Institute for Nuclear Research et
de scientifiques du Lawrence Livermore National Laboratory
(USA).