 Equilibre des systèmes chimiques
Equilibre des systèmes chimiquesLa plupart des réactions vues au cours de chimie sont des réactions directes et complètes du genre :
Dans plusieurs réactions cependant, les produits obtenus peuvent réagir entre eux pour reformer les substances initiales. De telles réactions sont dites réversibles.
Exemple : Quand on chauffe du tétraoxyde d'azote, ce gaz brun pâle se transforme en dioxyde d'azote, un gaz rouge-brun.
Inversément, quand on refroidit le dioxyde d'azote, la réaction inverse se passe :
On écrit ce genre de réaction en utilisant une double flèche qui signifie que, dans la réaction directe, de gauche à droite, les réactifs sont à gauche et les produits à droite tandis que dans la réaction inverse, de droite à gauche, les réactifs sont à droite et les produits à gauche.
On écrira donc les deux réactions précédentes de la façon suivante :
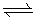 2NO2(g)
2NO2(g)
Puisque les deux réactions peuvent se produire, il est logique de se demander si les réactions sont toujours réversibles.
De fait, la plupart des réactions sont plus ou moins réversibles. Cependant, si un ou plusieurs produits de la réaction sont retirés du système, la réaction inverse devient impossible et la réaction directe devient complète ou irréversible
On peut considérer qu'un produit est retiré du milieu si :
Ex. : Quand l'acide chlorhydrique réagit sur du zinc, il y a dégagement d'hydrogène. Puisque ce dernier quitte le milieu, la réaction est complète.
 Zn(s) + 2HCl(aq) ¾® ZnCl2 (aq) + H2 (g)
Zn(s) + 2HCl(aq) ¾® ZnCl2 (aq) + H2 (g)
Ex. : Quand le chlorure de sodium, NaCl, et le nitrate d'argent, AgNO3, réagissent en solution aqueuse, la réaction est complète parce qu'il y a formation d'un précipité de chlorure d'argent, insoluble dans l'eau.
ou, sous forme d'équation ionique simple :
 Cl-(aq) + Ag+(aq) ¾® AgCl(s)
Cl-(aq) + Ag+(aq) ¾® AgCl(s)
Ex. : Quand l'acide chlorhydrique et l'hydroxyde de sodium se neutralisent l'un l'autre, il y a formation d'eau. Comme l'eau ne s'ionise que très faiblement, le retrait des ions hydronium et hydroxyde est à peu près total. La réaction est complète.
 H3O+ + OH - ¾® 2H2O
H3O+ + OH - ¾® 2H2O
ou, sous forme d'équation plus simple :
 H+ + OH - ¾® H2O
H+ + OH - ¾® H2O
| Voir la suite ... |