
Pour qu'un système chimique soit en équilibre, il faut que la réaction réversible se passe en milieu fermé, c'est-à-dire un milieu d'où aucune substance ne puisse s'échapper et qui ne subit aucun changement de température ou de pression. En pratique, sauf s'il y a dégagement de gaz, on considère qu'un bécher ou un tube à essai sont des milieux fermés, du moins pour un moment (peu d'évaporation, ...).
Dans un tel système, il y a équilibre quand la
vitesse de la réaction directe est égale à
celle de la réaction inverse. Si nous pouvons faire varier
la vitesse d'une de ces réactions sans modifier celle de
l'autre, la position de l'équilibre
sera modifiée.

Variation de la concentration
Quand du sulfure d'hydrogène passe dans une solution de
sulfate de fer(II), un précipité noir de sulfure de
fer(II) se forme :
 FeSO4
(aq) + H2S(aq)
FeSO4
(aq) + H2S(aq)  FeS(s) +
H2SO4 (aq)
FeS(s) +
H2SO4 (aq)
Si l'on ajoute de l'acide sulfurique dilué au
mélange, la concentration
d'un des facteurs de droite augmente et la réaction
inverse devient plus vive :
 FeSO4
(aq) + H2S(aq)
FeSO4
(aq) + H2S(aq) 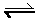 FeS(s) +
H2SO4 (aq)
FeS(s) +
H2SO4 (aq)
La réaction inverse sera prédominante
jusqu'à ce que le système arrive à un nouvel
état d'équilibre :
 FeSO4
(aq) + H2S(aq)
FeSO4
(aq) + H2S(aq) 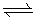 FeS(s) +
H2SO4 (aq)
FeS(s) +
H2SO4 (aq)
Variation de la température
Quand on chauffe du chlorure d'ammonium, de l'ammoniac et du
chlorure d'hydrogène sont produits :
 NH4CL(s)
NH4CL(s)  NH3 (g) + HCl(g)
NH3 (g) + HCl(g)
Si on laisse ces deux gaz se refroidir au contact l'un de
l'autre, la réaction inverse s'intensifie et des cristaux
de chlorure d'ammonium se reforment :
 NH4CL(s)
NH4CL(s) 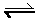 NH3 (g) + HCl(g)
NH3 (g) + HCl(g)

Jusqu'à ce qu'on obtienne un nouvel état
d'équilibre :
 NH4CL(s)
NH4CL(s) 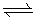 NH3 (g) + HCl(g)
NH3 (g) + HCl(g)
Variation de la pression
Comme on peut s'en douter, la pression affecte surtout les réactions impliquant des gaz.
Une augmentation de pression favorise la réaction vers
le côté où il y a le moins de
molécules. Par exemple, l'ammoniac est produit sous fortes
pressions :
 N2 (g)
+ 3H2 (g)
N2 (g)
+ 3H2 (g)  2NH3 (g)
2NH3 (g)
Une diminution de pression favorise la réaction vers le
côté où il y a le plus de molécules
:
 N2 (g)
+ 3H2 (g)
N2 (g)
+ 3H2 (g) 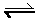 2NH3 (g)
2NH3 (g)
La pression n'aura pas d'influence sur l'équilibre
quand il y a autant de molécules à gauche
qu'à droite de la double flèche :
 H2 (g)
+ I2 (g)
H2 (g)
+ I2 (g) 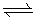 2HI(g)
2HI(g)
En conclusion, on peut dire que l'équilibre est un compromis entre un niveau minimum d'énergie et un niveau maximum de désordre.
Il est vrai que ce principe peut s'appliquer aussi à beaucoup d'entre nous, comme dirait le Professeur Mokeur !
En 1888, un chimiste français, Henry Le Châtelier a exprimé ainsi la loi générale qui porte à présent le nom de "principe de Le Châtelier" :
Si on modifie les conditions imposées à un système initialement en équilibre, ce dernier réagit de manière à favoriser la réaction qui s'oppose à ces modifications.