Équilibrer une équation rédox par des demi-réactions
1. Déterminer les électrons gagnés et perdus
-
Trace une flèche au dessus
pour indiquer la réduction (e -
gagnés).
Le nombre gagné l'est pour "chaque" Mn.
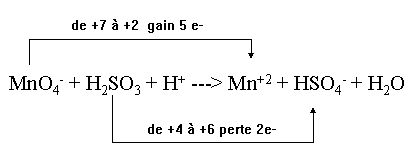
- En bas, trace une flèche
indiquant l'oxydation (e - perdus).
Ce nombre indique la perte pour "chaque" S.
2a. Écris la demi-réaction de réduction.(Flèche supérieure à l'étape 1)
 Mn+2
Mn+2
2b. Équilibre en ce qui concerne les atomes/ions.
- Indique les électrons
gagnés du côté des
réactifs.
Ajoute de l'eau du côté qui a besoin d'oxygène.
Ajoute H + de l'autre côté.
 Mn+2 + 4H2O
Mn+2 + 4H2O
3a. Écris la
demi-réaction d'oxydation. (Flèche inférieure dans
l'étape 1.)
 HSO4-
HSO4-
3b. Équilibre en ce qui concerne les atomes/ions.
Ajoute de l'eau du côté qui a besoin d'oxygène.
Ajoute H + de l'autre côté.
 HSO4- + 2e
- + 3H +
HSO4- + 2e
- + 3H + Mn+2 + 4H2O ) X 2 = 10 e
-
Mn+2 + 4H2O ) X 2 = 10 e
-
 HSO4- + 2e
- + 3H+ ) X 5 = 10 e -
HSO4- + 2e
- + 3H+ ) X 5 = 10 e -
4b. Multiplie les coefficients
pour équilibrer chaque demi-réaction en ce
qui concerne les e -.
 2Mn+2 + 8H2O
2Mn+2 + 8H2O
 5HSO4- + 10e
- + 15H +
5HSO4- + 10e
- + 15H +
 2Mn+2 + 8H2O +
5HSO4- + 10e - + 15H
+
2Mn+2 + 8H2O +
5HSO4- + 10e - + 15H
+
6. Simplifie l'équation.
Hydrogène, électrons
et eau figurent de chaque côté.
Pour chaque substance, annule des nombres égaux de
chaque côté de l'équation.
7. Reformule l'équation équilibrée.
 2Mn+2 +
5HSO4- + 3H2O
2Mn+2 +
5HSO4- + 3H2O
Vérifie que les électrons, les éléments et la charge totale sont équilibrés.L'équation équilibrée ci-dessus indique:
- aucun électron de chaque côté. Cela devrait TOUJOURS être le cas!
- la même quantité de chaque élément des deux côtés.
- la même charge totale (-1) des deux côtés.
L'équation est équilibrée correctement.
Rappelle-toi que nous n'avons pas indiqué les symboles de l'état physique. Au secondaire, tu devrais les avoir dans ton équation.