Oxydation-Réduction - Réactions
"Rédox"
Réactions au cours desquelles des atomes ou des ions
subissent des changements dans leur structure électronique.
 L'oxydation
se définit par: L'oxydation
se définit par:
- la perte d'électrons par un atome ou un ion.
- et aussi par la combinaison d'oxygène avec d'autres substances.
|
 La
réduction se définit par: La
réduction se définit par:
- le gain d'électrons par un atome ou un ion.
- et aussi par la "réduction" d'une substance en ses composants.
|
Comment savez-vous
qu'il s'agit d'une équation "Rédox"?
Réponse |
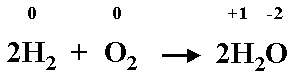 |
 |
Oxydation et Réduction doivent
toutes deux se passer dans une réaction
Rédox.
Si une particule gagne des électrons
dans une réaction, une autre particule doit les perdre. Vous pouvez trouver le nombre d'oxydation des éléments
dans le tableau périodique. Bien que ces informations soient importantes,
les règles suivantes doivent vous guider lors de travaux comportant
des équations Rédox. |
|
 Règles
pour assigner les nombres d'oxydation: Règles
pour assigner les nombres d'oxydation:
- Le nombre d'oxydation d'un élément libre = 0.
- Le nombre d'oxydation d'un ion monoatomique = charge de l'ion.
- Le nombre d'oxydation de l'hydrogène = + 1 et rarement
- 1.
- Le nombre d'oxydation de l'oxygène = - 2 et dans les peroxydes
- 1.
- La somme des nombres d'oxydation dans un ion polyatomique = charge
de l'ion.
- Les nombres d'oxydation des éléments des groupes
1 et 2 ainsi que de l'aluminium sont toujours ceux donnés par
le tableau périodique.
|
 Le
nombre d'oxydation des éléments non couverts par ces règles
doivent être "calculés" en utilisant les nombres d'oxydation
connus dans un composé. Le
nombre d'oxydation des éléments non couverts par ces règles
doivent être "calculés" en utilisant les nombres d'oxydation
connus dans un composé. |
| Exemple #1: |
K2CO3 |
selon la règle,
K est + 1
selon la règle,
O est - 2 |
Pour calculer C
La somme de tous les nombres d'oxydation dans cette formule est
égale à 0. Multiplier l'indice par le nombre d'oxydation pour
chaque élément:
K = (2) ( + 1
) = + 2
O = (3) ( - 2 ) = - 6
donc C = (1) ( + 4 ) = +
4 |
| Exemple #2: |
HSO4- |
selon la règle,
H est + 1
selon la règle,
O est - 2 |
Pour calculer S
La somme de tous les nombres d'oxydation dans cette formule est
égale à -1. Multiplier l'indice par le nombre d'oxydation
pour chaque élément:
H = (1) ( +
1 ) = + 1
O = (4) ( - 2 ) = - 8
donc S = (1) ( + 6 ) = +
6 |
| Pour s'exercer:
Utilisez les règles ci-dessus pour déterminer le nombre
d'oxydation de l'élément indiqué dans chaque formule: |
1. Sb dans Sb2O5
2. N dans Al(NO3)3
3. P dans Mg3(PO4)2
4. S dans (NH4)2SO4
5. Cr dans CrO4-2 |
6. Cl dans ClO4-
7. B dans NaBO3
8. Si dans MgSiF6
9. I dans IO3-
10. N dans (NH4)2S |
11. Mn dans MnO4 -
12. Br dans BrO3 -
13. Cl dans ClO -
14. Cr dans Cr2O7 -2
15. Se dans H2SeO3 |

Agents réducteurs et agents oxydants
- Agent réducteur - le réactif qui donne des
électrons.
- L'agent réducteur contient l'élément qui est
oxydé (qui perd des électrons).
- Si une substance perd facilement des électrons, on dit qu'elle
est un agent réducteur fort.
|
- Agent oxydant: - le réactif qui gagne des électrons.
- L'agent oxydant contient l'élément qui est réduit
(gagne des électrons).
- Si une substance gagne facilement des électrons, on dit qu'elle
est un agent oxydant fort.
|
Exemple: Fe2O3 (cr) + 3CO(g)  2Fe(l) + 3CO2 (g)
2Fe(l) + 3CO2 (g)
- Notez que le nombre d'oxydation de C va de +2 à gauche
à +4 à droite.
- L'agent réducteur est CO parce qu'il contient C qui perd
des e -.
|
- Notez que le nombre d'oxydation de Fe va de +3 à gauche
à 0 à droite.
- L'agent oxydant est Fe2O3parce qu'il contient
Fe qui gagne des e -.
|
Repérage des agents réducteurs
et oxydants
Pour s'exercer:
Dans toute équation Rédox , au
moins une particule gagnera des électrons et au
moins une particule perdra des électrons. Cela est révélé
par un changement dans le nombre d'oxydation de la particule d'un côté
de l'équation à l'autre. Pour chaque réaction ci-dessous,
dessine des flèches et indique les nombres d'oxydation comme
dans cet exemple. La flèche supérieure indique l'élément
qui gagne des électrons (réduction)et
la flèche inférieure indique l'élément qui
perd des électrons (oxydation).
Une flèche indique quel atome de
chaqun de ces éléments gagne ou perd des électrons. |
 Voici la première
chose à faire pour équilibrer une réaction Rédox.
Apprends à bien la faire. Voici la première
chose à faire pour équilibrer une réaction Rédox.
Apprends à bien la faire.
|
1. Mg + O2  MgO MgO 
2. Cl2 + I -  Cl - + I2 Cl - + I2 
3. MnO4 - + C2O4 -2  Mn+2 + CO2 Mn+2 + CO2
4. Cr + NO2 -  CrO2 - + N2O2 -2 CrO2 - + N2O2 -2
5. BrO3 - + MnO2  Br - + MnO4 - Br - + MnO4 -
|
6. Fe+2 + MnO4 -  Mn+2 + Fe+3 Mn+2 + Fe+3
7. Cr + Sn+4  Cr+3 + Sn+2 Cr+3 + Sn+2
8. NO3 - + S  NO2 + H2SO4 NO2 + H2SO4
9. IO4- + I -  I2 I2
10. NO2 + ClO -  NO3 - + Cl - NO3 - + Cl -
|
Équilibrer des équations
rédox par la méthode des demi-réactions:
|
1. Décide de ce qui est
réduit (agent oxydant) et de
ce qui est oxydé (agent réducteur).
- Fais cela en dessinant des flèches comme dans l'exercice
ci-dessus.
2. Écris la demi-réaction de réduction.
- La flèche supérieure de cette première
étape indique la demi-réaction de réduction.
- Montre les électrons gagnés du côté
du réactif.
- Équilibre en ce qui concerne les atomes/ions.
|
 |
Rappelle-toi que dans cette première étape cette flèche
indique le nombre d'électrons gagnés par un atome. |
3. Écris la demi-réaction
d'oxydation.
 |
Rappelle-toi que dans cette première étape cette
flèche indique
le nombre d'électrons perdus par un atome. |
4. Le nombre d'électrons
gagnés doit égaler le nombre d'électrons
perdus.
-
Trouve le plus petit commun multiple des électrons
gagnés et perdus.
-
Dans chaque demi-réaction, multiplie le coefficient
des électrons par un nombre qui permette d'atteindre le plus
petit commun multiple.
-
Multiplie tous les coefficients
de la demi-réaction par ce même nombre.
5. Ajoute les deux demi-réactions.
6. Simplifie l'équation.
 |
Vérifie pour être certain que les électrons,
les éléments et la charge totale sont équilibrés.
- Il ne devrait plus y avoir d'électrons dans l'équation
à ce moment.
- Le nombre de chaque élément devrait être
le même des deux côtés.
- Peu importe la charge pourvu qu'elle soit la même des
deux côtés.
|
| Si l'une de ces conditions n'est pas remplie, l'équation
est incorrecte. La seule chose à faire est de retourner à
la première étape et de trouver l'erreur. |
Le nombre d'oxydation des éléments
change d'un côté à l'autre.
Le nombre d'oxydation de l'hydrogène est 0 à
gauche et +1 à droite.
Le nombre d'oxydation de l'oxygène est 0 à gauche et -2 à
droite.
Réponses
pour les nombres d'oxydation:
1. Sb + 5
2. N + 5
3. P + 5
4. S + 6
5. Cr + 6
6. Cl + 7
7. B + 5
8. Si + 4
9. I + 5
10. N - 3
11. Mn + 7
12. Br + 5
13. Cl + 1
14. Cr + 6
15. Se + 4
|
Agents réducteurs et
oxydants:
- agent oxydant - H2SO4 || agent réducteur
- HI
- agent oxydant - H2O || agent réducteur - CaC2
- agent oxydant - Au2S3 || agent réducteur
- H2
- agent oxydant - HCl || agent réducteur - Zn
|
Équations
rédox équilibrées:
1. 2HNO3 + 3H3PO3  2NO + 3H3PO4 + H2O 2NO + 3H3PO4 + H2O |
 |
2. 14H+ + Cr2O7-2 + 6I -  2Cr+3 + 3I2 + 7H2O 2Cr+3 + 3I2 + 7H2O |
 |
3. 3As2O3 + 4H+ + 4NO3- + 7H2O  6H3AsO4 + 4NO 6H3AsO4 + 4NO |
 |
4. CuS + 2NO3- + 4H+  Cu+2 + 2NO2 + S + 2H2O Cu+2 + 2NO2 + S + 2H2O |
 |
5. H2SeO3 + 4Br - + 4H+  Se + 2Br2 + 3H2O Se + 2Br2 + 3H2O |
 |
6. 6Fe+2 + Cr2O7-2 + 14H+  6Fe+3 + 2Cr+3 + 7H2O 6Fe+3 + 2Cr+3 + 7H2O |
 |
7. 3HS - + IO3- + 3H+  I - + 3S + 3H2O I - + 3S + 3H2O |
 |
8. 16H+ + 2CrO4-2 + 6I -  2Cr+3 + 3I2 + 8H2O 2Cr+3 + 3I2 + 8H2O |
 |
9. 8H+ + IO4- + 7I -  4I2 + 4H2O 4I2 + 4H2O |
 |
10. 6H+ + 2MnO4- + 5H2O2  2Mn+2 + 5O2 + 8H2O 2Mn+2 + 5O2 + 8H2O |
 |
11. 8H+ + H3AsO4 + 4Zn  AsH3 + 4Zn+2 +
4H2O AsH3 + 4Zn+2 +
4H2O |
 |
| Plus d'équations rédox: |
- MnO4 - + SO3 -2
 Mn +2 + SO4 -2 Mn +2 + SO4 -2
- H3PO2 + Cr2O7 -2
 H3PO4 +
Cr +3 H3PO4 +
Cr +3
- HNO3 + H3AsO3
 NO + H3AsO4 NO + H3AsO4
|
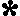 L'oxydation
se définit par:
L'oxydation
se définit par:
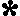 La
réduction se définit par:
La
réduction se définit par:


 2Fe(l) + 3CO2 (g)
2Fe(l) + 3CO2 (g)