(Velocidad de Reacción)
Por:
Edith Hernández Hernández
8 de enero de 2003
Se
determinaron
experimentalmente la ecuaciones de la
velocidad de reacción primeramente en función de la
concentración y posteriormente en función de
la temperatura, entre
el sulfato de sodio con yodato
de potasio en presencia
de almidón
como indicador,
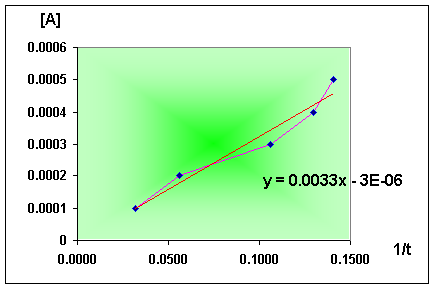
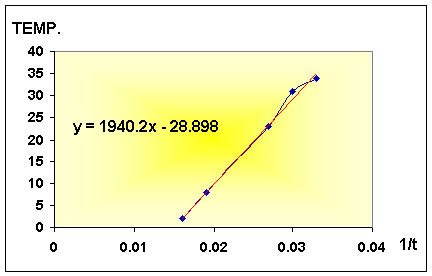
dando como resultado: Y = 0.0033 X - 3E-06 en el primer caso, Y = 1940.2 X + 28.898
para el segundo caso, cuando se efectúo
la reacción
se observó el final de la misma
mediante el cambio de coloración, midiéndose diferentes tiempos.
La velocidad de reacción a la cual prosigue una reacción, expresada en términos
del aumento o disminución de un número pequeño de factores que controla
la rapidez con que ocurre una reacción. La cinética química estudia la rapidez o
velocidad de las reacciones químicas, por ejemplo
en función de; la concentración, temperatura,
mecanismos de reacción, catalizador. Para que tenga lugar una reacción entre
dos partículas, las mismas deben acercarse lo suficiente para que los electrones
de su capa exterior interactúen.
El objetivo fue determinar la ecuación empírica que relacione
la velocidad de una reacción, variando alguno de los parámetros que la afectan.
El objeto de estudio fue la determinación de la velocidad de reacción
en función de la variación de la concentración del KIO3, así como de
la temperatura, particular del sistema.
En la hipótesis se se planteó
obtener la ecuación de la velocidad
de reacción en función de la concentración y temperatura
tomando como modelo matemático
la ecuación general.
y
=
mx
+
b .
Las velocidades de reacción
dependen generalmente de las concentraciones de las sustancias reaccionantes. Para
la mayoría de las reacciones, las velocidades son más elevadas cuando las concentraciones
de los reactivos son elevadas. Altas concentraciones significan que un número relativamente
grande de moléculas están juntas en un volumen dado, bajo estas condiciones, las
colisiones entre moléculas reaccionantes que las convierten en moléculas de producto,
son relativamente frecuentes y por consiguiente la reacción es más rápida.
Al aumentar la temperatura
de los reactantes, aumentará la energía cinética de las partículas, esto no solo
aumentará la frecuencia de las colisiones si no también la probabilidad de que las
partículas que chocan tengan suficiente energía para sobrepasar la barrera de la
energía de activación. Los cambios de temperatura tienen efectos importantes sobre
los organismos vivientes, la fiebre aumenta la velocidad de las reacciones químicas
en el organismo, como es la aceleración del pulso, las anormalidades del sistema
nervioso y digestivo.
Muchas reacciones que
se producen lentamente pueden desarrollarse a una velocidad más rápida, mediante
la introducción de sustancias conocidas como catalizadores. Un catalizador
es una sustancia que aumenta la velocidad de una reacción, sin ser consumida en
ella, el efecto del catalizador es el efecto de disminuir la energía de activación
requerida para la reacción. La industria utiliza ampliamente los catalizadores,
especialmente aquellos que permiten a las compañías producir grandes cantidades
de un producto a una temperatura más baja, ahorrando con ello costos de energía.
|
MATERIAL: |
SUSTANCIAS y REACTIVOS: |
|
Cronometro |
Agua. |
|
Etiquetas |
Solución
.02 M de KIO3 |
|
Matraces erlenmeyer |
Solución
.008 M de Na2SO3 |
|
Vasos de precipitado |
Ácido Sulfúrico
|
|
Buretas de 50 ml
|
Almidón soluble.
|
|
Embudos |
|
|
Matraz aforado
de un litro |
|
|
Soportes universales
|
|
|
Pinzas de
tres dedos
|
|
|
Parrilla de
agitación
|
|
|
Agitador magnético |
|
|
Saca magneto
|
|
|
Termómetro |
|
|
Pipeta graduada
de 10 ml |
|
METODOLOGÍA:
Para la variación de la concentración.
Se prepararon
las soluciones .02 M de KIO3 y .008M de Na2SO3
y se etiquetan y enumeran cada uno de los vasos de precipitado y matraces.
En los vasos de precipitado
se agregaron los reactivos ayudándonos del material de laboratorio y de acuerdo
a la siguiente tabla se depositaron los volúmenes
adecuados.
|
Vaso
|
Sol.
0.02 M KIO3
|
Agua (H2O)
|
|
1
|
5ml
|
45ml
|
|
2
|
10ml
|
40ml
|
|
3
|
15ml
|
35ml
|
|
4
|
20ml
|
30ml
|
|
5
|
25ml
|
25ml
|
De la misma
manera en los matraces se depositaron los volúmenes adecuados
de acuerdo a la siguiente tabla.
|
Matraz
|
0.008
M de Na2SO3.
|
Agua
|
Sol. almidón
|
|
1
|
10 ml
|
39.5ml
|
.05 ml
|
|
2
|
10 ml
|
39.5ml
|
.05 ml
|
|
3
|
10 ml
|
39.5ml
|
.05 ml
|
|
4
|
10 ml
|
39.5ml
|
.05 ml
|
|
5
|
10 ml
|
39.5ml
|
.05 ml
|
En la parrilla
de agitación se colocó el vaso de precipitado # 1 con el respectivo agitador
magnético, se vacío el liquido del matraz #1
en dicho vaso lo más rápidamente y
se determinó
el tiempo, como se realizaron cinco corridas experimentales se hizo el mismo
procedimiento para cada vaso y matraz.
Para la variación
de la temperatura.
Nuevamente
se etiquetaron
y enumeraron
cada uno de los vasos de precipitado y matraces,
debiendo estar bien
lavados.
En los vasos de precipitado
se agregaron los reactivos ayudándonos del material de laboratorio de acuerdo
a la siguiente tabla se depositaron los volúmenes
correspondientes.
|
Vaso
|
Sol.
0.02 M KIO3
|
Agua (H2O)
|
|
1
|
5ml
|
45ml
|
|
2
|
5ml
|
45ml
|
|
3
|
5ml
|
45ml
|
|
4
|
5ml
|
45ml
|
|
5
|
5ml
|
45ml
|
De la misma
manera en los matraces se deposito los volúmenes adecuados mediante la siguiente
tabla.
|
Matraz
|
0.008
M de Na2SO3.
|
Agua
|
Sol. almidón
|
|
1
|
10 ml
|
39.5ml
|
.05 ml
|
|
2
|
10 ml
|
39.5ml
|
.05 ml
|
|
3
|
10 ml
|
39.5ml
|
.05 ml
|
|
4
|
10 ml
|
39.5ml
|
.05 ml
|
|
5
|
10 ml
|
39.5ml
|
.05 ml
|
El vaso
de precipitado y matraz # 1 se enfriaron hasta que la temperatura
alcanzó 2°C, en la parrilla de agitación se
colocó
el vaso de precipitado # 1 con el respectivo agitador magnético, se vació el
liquido del matraz #1 a dicho vaso lo más rápidamente y se
determinó
el tiempo, se procedió de la misma manera
pero
aumentando
la
temperatura en el vaso #2 a 8°C, el #3 a 23°C, el #4 a 31°C y por último el
# 5 a 34°C.
|
Cinética Química (Velocidad de Reacción)
[
KIO3 ] vs. 1 /
tiempo
|
|
|
 |
Coloca tu mouse
encima de cualquiera de las imágenes para ver más resultados experimentales
|
Cinética Química (Velocidad de Reacción)
Temp. vs. 1 /
tiempo
|
|
|
 |
En la primera parte experimental
nos dimos cuenta que mientras estaba más concentrada la reacción su velocidad aumentaba
en resumen a mayor concentración mayor es la velocidad de reacción.
En la segunda
parte del experimento nos dimos cuenta que también ocurría que; a mayor temperatura la tendencia fue que
aumentó
la velocidad y así ocurrió entre más alta fuera la temperatura su velocidad de reacción
era más rápida.
Como
en todas las determinaciones hubo factores que alteraron al sistema en
esta ocasión fue que dos sustancias que se mezclaban deberían estar a la misma temperatura
pero esto no se realizó debido a que el yodato de potasio no se
debía
calentar porque se desprende el yodo,
así este
factor no fue muy notorio para la velocidad de reacción.
Se puede decir
que la hipótesis fue acertada ya que mediante los datos obtenidos se procedió a
graficar y a determinar las ecuaciones lineales.
Pudimos observar muy claramente
que
en la velocidad de reacción existen varios factores que la pueden alterar los que
estudiamos en este experimento fue la concentración
y que a mayor concentración más rápido
se efectúa la reacción, y a mayor temperatura es más rápida la reacción eso que
bien demostrado.
-
James E. Brady,
“Química Básica”, 2da., Ed. Limusa, México, D.F., 379-381.
-
Alcántara
María del Consuelo, “Química de Hoy”, Ed.
Mc Graw – Hill.
-
Chemical Education
Material, “Química, una Ciencia Experimental”, Ed. Editorial Reverte.
-
Mortimer C.
E., “Química”, Ed. Iberoamericana, México, D.F. Pág. 767, 1983.
|