Por: Aidé Marisol Carmona Rodríguez
27 de octubre de 2006
|
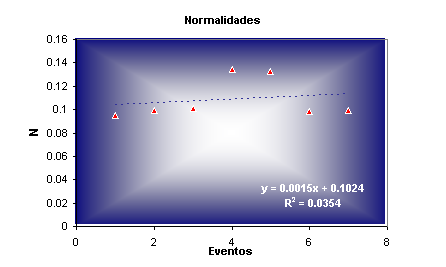
Mediante este proyecto experimental se llevó a cabo una titulación potenciométrica
con la cual se determinó la normalidad experimental de HCl, ésta última
se obtuvo al realizar la grafica No. 01, que contiene todos los resultados experimentales;
donde se aprecia que la normalidad experimental se aproxima a nuestra normalidad
teórica de 0.1N
|
|
By means of this experimental project you takes I a titration potentiometer, in
which you calculates the experimental normality of HCl, this last one was obtained
the No. 01graph that contains all the experimental results; where it is appreciated
that the experimental normality approaches to our theoretical normality of 0.1N
La titulación es la reacción entre volúmenes equivalentes de dos soluciones; el
ejemplo más común de titulación es la neutralización de un ácido por una base.
En las reacciones de neutralización de un ácido que reacciona con una base forman
una sal y en la mayoría de los casos se forma agua como producto secundario; ya
sea que el ácido se agregue a la base o viceversa.
En las titulaciones se utilizan diversos indicadores para conocer el punto de equivalencia;
es decir, el punto en el que el ácido a reaccionado o neutralizado completamente
a la base. A partir de los indicadores también se puede conocer si la solución con
la que se esta trabajando es una ácido o una base.
Este punto se suele identificar por el marcado cambio de color del indicador que
se ha agregado previamente a la base, sin embargo debe tomarse en cuenta que el
pH también puede ser medido mediante un potenciómetro; lo cual nos lleva a las titulaciones
ácido-base potenciométricas. En las cuales se determinan diversas curvas de titulaciones
ácido-base, con el pH en función del volumen de ácido o de base añadido. Estas curvas
pueden lograrse experimentalmente efectuando la titulación con un punto final potenciométrico,
tomando la pendiente máxima como punto final. Este tipo de titulaciones son muy
útiles cuando la indicación visual resulta difícil debido a la presencia de colorantes
en la solución titulada. (Mortimer 1983)
|
Las soluciones
acuosas de los
generalmente tienen las siguientes propiedades:
-
Sabor agrio
-
Neutralizan
las bases
|
En general
las soluciones acuosas de las
, tienen las siguientes propiedades:
|
Tanto a los ácidos como a las bases se les aplica el principio de fuertes;
es decir que son sustancias completamente ionizadas ó débiles; cuando las
sustancias están parcialmente ionizadas (Garzón 1990).
Algunas definiciones de ácidos y bases son las siguientes:
|
.Arrhenius:
-
Ácido: como
la sustancia que cede iones de hidrógeno (H+) cuando se disuelve en agua.
-
Base: como la
sustancia que cede iones hidróxidos (OH-) cuando se disuelve en agua.
|
Bronsted y Lowry:
-
Ácido: cualquier sustancia que puede donar un protón (ión H+) a otra.
-
Base: cualquier sustancia que puede aceptar un protón (H+) de otra sustancia.
|
Se intenta determinar la concentración del ácido con un patrón primario, aplicando
el proceso de la titulación.
De la misma manera se espera que la concentración del ácido clorhídrico sea de 0.1N
para una concentración de 0.1N de Carbonato de sodio.
MATERIAL Y SUSTANCIAS:
|
Material
|
Sustancias
|
|
Soporte Universal |
Agua destilada H2O
|
|
Potenciómetro |
Carbonato de sodio Na2CO3 |
|
Parilla de agitación |
Ácido clorhídrico HCl |
|
Matraz aforado de 500 mL |
Solución buffer pH 4.0 |
|
Agitador magneto |
Solución buffer pH 7.0 |
|
Vasos de precipitados de 150 mL |
Solución buffer pH 10.0 |
|
Desecador |
|
|
Pinzas dobles de presión |
|
|
Mufla |
|
|
Papel aluminio |
|
|
Papel higiénico (suave) |
|
|
Cápsula de porcelana |
|
|
Pinzas para cápsula |
|
|
Bureta de 50ml |
|
|
I. Preparación
del desecador
|
|
Se construyó
una charola de papel aluminio en la cuál se colocó la sílica y se introdujo ésta
a la estufa durante 30 minutos a una temperatura de 100 °C. Según se aprecia en
la figura 1 y 2.
|
 |
 |
|
|
Fig. 1
Colocando la sílica en la charola
|
Fig. 2
Introduciendo
la charola dentro de la estufa
|
|
Posteriormente, se limpió el desecador e introdujo la sílica ya activada. Según
se aprecia en las figuras
3 y 4.
|
 |
 |
|
|
Fig. 3
Limpiando el desecador
|
Fig. 4
Colocando la sílica dentro del desecador
|
|
II. Deshidratar el Carbonato de Sodio
(Na2CO3)
|
|
Para deshidratar
el carbonato, éste se colocó en una cápsula de porcelana y se introdujo a
la mufla a 300°C durante una hora. Ver figura 5. Concluido lo anterior se
retiró la cápsula y se colocó dentro del desecador para mantener el carbonato
libre de humedad. Ver figura 6.
|
 |
 |
|
|
Fig. 5
Introduciendo
la cápsula en la mufla.
|
Fig. 6
Cápsula en el desecador
|
|
III. Preparación
de la solución del ácido
|
|
Se agregó agua dentro de un matraz de aforo, enseguida
se agregaron 4.27 mL de HCl, se aforó el matraz y se agitó para obtener la solución.
Según la figura 7, y 8.
Concluido lo anterior se vació la solución en una botella de plástico y se etiquetó.
|
 |
 |
|
|
Fig. 7
Agregando ácido clorhídrico al matraz
|
Fig. 8
Agitando el matraz
|
|
IV. Calibración del potenciómetro
|
Se enjuagó el electrodo del potenciómetro, posteriormente se sumergió en cada una
de las soluciones buffer, quedando así calibrado el potenciómetro.
|
V. Preparación
de las soluciones de carbonato
|
|
Se pesó una pequeña muestra de carbonato de sodio. Según se aprecia en la
Figura 9. Concluido lo anterior se disolvió el carbonato en agua, para titular
el HCl. repitiendose la operación en seis corridas experimentales. Ver figura 10.
|
 |
 |
|
|
Fig. 9
Pesando el carbonato
|
Fig. 10
Disolviendo el carbonato de sodio
|
|
VI. Titulación,
Reacción ácido-base
|
|
Se aforó la bureta con ácido clorhídrico, y
se sumergió el electrodo del potenciómetro en la solución de carbonato. Según se
aprecia en la figura 11. Posteriormente, se comenzó a titular; agitando constantemente,
y realizando la medición del pH con ayuda del potenciómetro, y el volumen
de ácido consumido (este proceso se realizó para siete corridas
experimentales). Ver figura 12.
|
 |
 |
|
|
Fig. 11
Sumergiendo el electrodo en la solución.
|
Fig. 12
Adicionando el ácido y midiendo el pH
|
|
No. Corridas
|
Volumen Reactivo
|
Normalidades Experimentales
|
Normalidad Promedio
|
Desviación Estándar |
|
|
1
|
31.50
|
0.095
|
|
|
|
|
2
|
30.25
|
0.099
|
|
|
|
|
3
|
29.50
|
0.101
|
|
|
|
|
4
|
22.25
|
0.134
|
|
|
|
|
5 |
22.25 |
0.133 |
|
|
|
|
6 |
30.75 |
0.098 |
|
|
|
|
7 |
30.25 |
0.099 |
|
|
|
|
|
|
|
0.1089 |
0.0122263 |
|
Al agregar el ácido clorhídrico a la solución de carbonato de sodio, se pudo observar
por medio del potenciómetro, que el pH disminuía con cada incremento de ácido.
Se puede observar que los resultados varían un poco en cada corrida experimental,
esto se debe en parte a que en las soluciones de carbonato de sodio, los gramos
del mismo no son exactamente iguales.
Por otra parte, el potenciómetro influye de cierto modo; ya que se utilizó uno digital
y otro de aguja y la forma de realizar las lecturas es distinta.
Por tanto la normalidad experimental se aproximó a nuestra normalidad teórica de
0.1N y se puede decir que nuestra hipótesis se cumplió; debido a que nuestra normalidad
experimental varia con respecto a la teórica, debe tomarse en cuenta todos los factores
que alteran los resultados.
-
GARZÓN G. Guillermo, Fundamentos de Química General, Colombia 1990,
pp. 472
-
MORTIMER E. Charles, Química, Primera Edición en Español México
1983, pp. 768
|