การนำไฟฟ้าของสาร
ไฟฟ้าสถิตและไฟฟ้ากระแส
ไฟฟ้าสถิต หมายถึง อำนาจไฟฟ้าที่เกิดขึ้นเฉพาะแห่ง เนื่องจากประจุไฟฟ้าไม่เคลื่อนที่ในวัตถุชนิดนั้น ๆ เช่น เมื่อถูแท่งพลาสติกด้วยผ้าสักหลาด แท่งพลาสติกบริเวณที่มีการถูจะแสดงอำนาจไฟฟ้าได้ เนื่องจากขณะที่นำพลาสติกไปถูผ้าสักหลาด จะทำให้ประจุไฟฟ้าที่อยู่ในพลาสติกแยกออกจากกัน และแสดงอำนาจไฟฟ้าบวกหรือลบ แล้วแต่ว่าบริเวณนั้นจะมีประจุชนิดใดมากกว่ากัน อำนาจไฟฟ้าจึงเกิดขึ้นบริเวณที่ถู
จากความรู้เรื่องไฟฟ้าสถิต ทำให้นักวิทยาศาสตร์เชื่อว่าสารต่าง ๆ จะมีประจุไฟฟ้า 2 ชนิด คือประจุไฟฟ้าบวกและประจุไฟฟ้าลบ การที่วัตถุไม่แสดงอำนาจไฟฟ้าหรือเป็นกลางทางไฟฟ้านั้นเป็นเพราะว่ามีปริมาณของประจุบวกและลบเท่ากัน เมื่อนำมาเชื่อมโยงกับอะตอมทำให้เชื่อกันว่าอะตอมก็ควรจะมีประจุเช่นเดียวกัน อะตอมที่เป็นกลางจะมีประจุบวกและลบเท่ากัน ดังนั้นอะตอมจึงไม่ควรจะเป็นหน่วยที่เล็กที่สุด
ไฟฟ้ากระแส หมายถึง อำนาจไฟฟ้าที่เกิดจากการเคลื่อนที่ของประจุไฟฟ้าผ่านตัวกลาง ตัวกลางที่ยอมให้ประจุไฟฟ้าเคลื่อนที่ผ่านเรียกว่า ตัวนำ เช่น โลหะต่าง ๆ ส่วนตัวกลางที่ไม่ยอมให้ประจุไฟฟ้าผ่านเรียกว่า ฉนวน
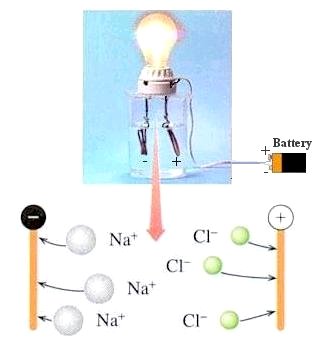
การนำไฟฟ้าของสารละลาย
สารละลายที่นำไฟฟ้าได้เรียกว่า สารละลายอิเล็กโทรไลต์(Electrolytic solution) เช่น สารละลายกรดเกลือ
- ถ้านำไฟฟ้าได้มากเรียกว่า สารละลายอิเล็กโทรไลต์แก่ (strong electrolyte) เช่น สารละลายโซเดียมคลอไรด์
- ถ้านำไฟฟ้าได้น้อยเรียกว่า สารละลายอิเล็กโทรไลต์อ่อน(weak electrolyte) เช่น สารละลายกรดอะซิติก
- ถ้าเป็นสารละลายที่ไม่นำไฟฟ้าเรียกว่า สารละลายนอนอิเล็กโทรไลต์ (Non-electrolytic solution) เช่น สารละลายกลูโคส
การที่สารละลายอิเล็กโทรไลต์ นำไฟฟ้าได้ เพราะในสารละลายมีไอออนซึ่งมีประจุไฟฟ้าเรียกว่า ไอออนบวก และไอออนลบ กล่าวคือ
เมื่อสารละลายในน้ำจะมีการแตกตัวออกเป็นสองส่วน และมีประจุตรงกันข้ามกัน แต่ละส่วนเรียกว่า ไอออน
- ไอออนส่วนหนึ่งจะมีประจุไฟฟ้าบวก เรียกว่า ไอออนบวก
- ไอออนอีกส่วนหนึ่งจะมีประจุไฟฟ้าลบเรียกว่า ไอออนลบ (มีปริมาณเท่ากับไอออนบวก)
เมื่ออยู่ในสนามไฟฟ้า ไอออนบวกจะเคลื่อนที่เข้าหาขั้วไฟฟ้าลบ และ ไอออนลบจะเคลื่อนที่เข้าหาขั้วไฟฟ้าบวก
ไอออนบวกที่เคลื่อนที่เข้าหาขั้วไฟฟ้าลบจะไปรับประจุลบหรืออิเล็กตรอน ส่วนไอออนลบที่เคลื่อนที่เข้าหาขั้วไฟฟ้าบวกจะเป็นตัวพาประจุลบไปให้ขั้วไฟฟ้า ไหลวนเวียนกันอยู่ในสารละลาย จึงก่อให้เกิดการนำไฟฟ้าขึ้น
การนำไฟฟ้าของก๊าซ
ที่ความดันปกติก๊าซจะไม่นำไฟฟ้า แม้ว่าจะเพิ่มความต่างศักย์ระหว่างขั้วไฟฟ้าให้มากขึ้น แสดงว่าก๊าซเป็นฉนวนไฟฟ้า ความต่างศักย์ที่ใช้ตามบ้านคือ 220 โวลต์ ก๊าซจะไม่นำไฟฟ้า แต่ในบางโอกาสจะพบว่าก๊าซสามารถนำไฟฟ้าได้ เช่น การเกิดฟ้าแลบ หรือฟ้าผ่าในขณะที่มีพายุฝนฟ้าคะนอง จากการศึกษาการนำไฟฟ้าของก๊าซพบว่า ก๊าซจะนำไฟฟ้าได้ดีขึ้นถ้าความดันของก๊าซต่ำลง และความต่างศักย์ระหว่างขั้วไฟฟ้ามากขึ้น
Electrolyte
From Wikipedia, the free encyclopedia
An electrolyte is a substance that dissociates into free ions when dissolved (or molten), to produce an electrically conductive medium. Because they generally consist of ions in solution, electrolytes are also known as ionic solutions. They are sometimes referred to in abbreviated jargon as lytes.