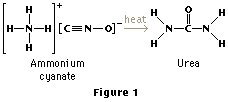
Federico Wöhler
(1800-1882)
Federico Wöhler, (1800-82), químico y educador Alemán, nacido en Eschersheim (ahora parte de Frankfurt), y educado en las universidades de Marburg y Heidelberg. Mientras estudiaba medicina en Heidelberg, se interesó en la química y fue a Estocolmo para estudiar con el químico sueco Jöns Jakob Berzelius. En 1836 se convirtió en profesor de química en la Universidad de Göttingen.
Pionero en el campo de química orgánica, Wöhler es famoso para su síntesis del compuesto orgánico urea. Por esta contribución él probó, contra diciendo al pensamiento científico de la época, que un producto de los procesos vivos de los animales podrían hacerse en el laboratorio a partir de materiales inorgánicos. Wöhler también condujo una importante investigación sobre el ácido úrico y el petróleo de almendras amargas, en colaboración con el químico alemán Justus von Liebig, y aisló los elementos químicos aluminio y berilio. El descubrió el carburo de calcio y preparo el acetileno a partir del carburo de calcio; él también desarrolló el método para preparar fósforo que es de uso común en estos días. Escribió un cantidad de libros de química orgánica y química mineral.
El advenimiento de la química orgánica se asocia frecuentemente con el descubrimiento de 1828 hecho por el químico alemán Federico Wöhler acerca de que la sustancia inorgánica, o el mineral, llamado cianato de amonio puede convertirse en urea en laboratorio, sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos pensaban que por la llamada fuerza de la vida era necesaria para la síntesis de sustancias orgánicas. El experimento de Wöhler rompió la barrera entre las sustancias orgánicas e inorgánicas. Los químicos modernos consideran compuestos orgánicos a los que contienen carbono y uno o más elementos, de los cuales la mayoría son el hidrógeno, oxígeno, nitrógeno, sulfuro, o los halógenos, pero a veces intervienen otros.
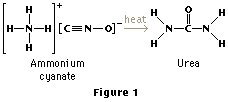
Formas Aleotrópicas del Carbono
El carbón puro existe en cualquiera de los cuatro alótropos, que son formas diferentes de cristal del mismo elemento. Estos alotropos son el diamante, grafito, carbón amorfo, y "fullerenes".
Diamante
El diamante puro es la sustancia más dura conocida. El diamante puro es incoloro y transparente, pero cuando contaminó con otros minerales puede aparecer en colores que tocan desde pasteles al negro opaco. El diamante es químicamente inerte pero se le puede inducir para quemarse en el aire a temperaturas muy altas. El mejor conductor de calor de cualquier sólido, es también un aislador eléctrico. Hasta 1955, los depósitos naturales de origen volcánico eran la única fuente de diamantes. Desde entonces, los diamantes usados para las agujas de fonógrafo y herramientas se han sintetizado a partir de grafito sometido a temperatura y presión altas. Los diamantes de calidad gema no son hechos de esta manera.
Las propiedades del diamante se derivan de su estructura cristalina, el cual se compone solamente de átomos de carbono tetraédricos interconectados, donde cada uno de los cuales esta covalentemente afianzado a los cuatro átomos vecinos. La fortaleza excepcional de la unión carbón - carbón y la estructura covalente interconectada rinde cuentas de la dureza del diamante.
Grafito
El grafito es una sustancia lustrosa negra que fácilmente se desmorona o descama y de sensación resbaladiza. Es químicamente inerte, aunque menos que el diamante, y es un conductor óptimo de calor y electricidad. Existe como mineral y puede producirse artificialmente a partir del carbón amorfo.
El grafito se compone enteramente de átomos de carbono trigonométricos planos unidos como un modelo de panal. Cada molécula de carbón se afianza a otros tres en ángulos de 120 grados. Estos planos se acomodan en hojas para formar cristales tridimensionales. Las capas se separan a una distancia que hace que exista una situación sin unión. Porque cada átomo se afianza formalmente solo a tres átomos vecinos, el balance de electrones restante (uno en cada átomo) es libre para circular dentro de cada plano de átomos, contribuyendo con la capacidad del grafito para conducir electricidad.
Uno de los usos principales del grafito -- como lubricante -- resulta de la característica resbaladiza de una capa sobre otra dentro de el cristal. La punta en lápices es realmente grafito. Se usa también como un material resistente al calor; como conductor eléctrico y electrodo (en pilas secas); y en reactores nucleares como un moderador de neutrones.
Carbono Amorfo
Menos bien definido que el diamante o el grafito, el carbono amorfo tiene propiedades físicas y químicas que pueden variar dependiendo de su método de fabricación y condiciones a las que se somete luego. Es un polvo negro obscuro que se encuentra en la naturaleza como un componente del carbón y lignito. Puede obtenerse artificialmente calentando casi cualquier sustancia orgánica a temperaturas muy altas con la ausencia de aire. De esta manera el coque se obtiene del carbón y del carbón vegetal. Quemando los vapores orgánicos con oxígeno insuficiente produce formas tales como carbón negro y humo negro. El carbono amorfo es la forma más reactiva del carbón. Se quema relativamente fácil en el aire, a partir de ser servido como combustible, y es atacado por fuertes oxidantes. Tiene algunos aspectos estructurales de grafito, pero su estructura atómica es mucho más irregular. Los usos más importantes del carbono negro son usarse como relleno estabilizador para el hule y los plásticos y como un pigmento negro en tintas y pinturas. El carbón y el coque se usan como combustibles limpios - quemadores. Ciertos tipos de
carbonos "activados" son útiles como absorbentes de gases y de impurezas de soluciones.
Fullerenes
En los 80's los científicos determinaron que otra forma alotrópica del carbono conjeturada por algunos años como una posibilidad desde luego ocurre: los átomos de carbón vinculados para formar más o menos una molécula esférica. Una familia entera de tales moléculas, con variación en el número de átomos, se conoce ahora como existente. A la primera en ser identificada y la más simétrica de la familia, con 60 átomos y 32 lados, se le apodó "buckyball" y de ahí en adelante se le nombro formalmente buckminsterfullere, porque honra al inventor de los domos geodésicos el estadounidense R. Buckminster Fuller. Las moléculas esféricas de carbón como grupo son llamadas fullerenes. Estas se han encontrado en amplias extensiones de carbón - que contienen materiales en la Tierra, y estas pueden ser moléculas interestelares bastante comunes.
La buckminsterfullerene esta ahora siendo producida en cantidades comerciales para uso científico. Sus propiedades superconductoras y su potencialidad para abrir áreas nuevas de química han hecho del estudio de las "buckyball" una de las áreas de investigación de mayor expansión.
Bibliografía
Libro : Enciclopedia Encarta’96
Editorial : Microsoft
Autor : ----------
Págs : Wöhler (Palabra)
Libro : Enciclopedia Grolier ’96
Editorial : SMS
Autor : ---------
Págs : Carbon (Palabra)