|
En 1884, Hans Christian Gram, un Médico danés que laboraba en Berlín, accidentalmente
descubrió un método para teñir y diferenciar bacterias. Empleaba cristal
violeta como colorante y una solución yodada potásica como mordente. Mientras examinaba
preparaciones de tejido pulmonar de pacientes que habían muerto por neumonía, descubrió que
el colorante era retenido por algunas bacterias y otras permanecían
incoloras después de lavar el frotis con etanol y agua. Clasificó a las
primeras como Gram-positivas y Gram-negativas a las segundas.
 
Posteriormente Carl Weigert introdujo la modificación por la
cual se incorporaba safranina como colorante de contraste al método
facilitando la diferenciación entre
positivas (violeta)
y negativas
(rosa/naranja).
 
|
El tamaño de la
mayoría de las células bacterianas es tal que resultan difíciles de ver con el
microscopio óptico. La principal dificultad es la falta de contraste entre la
célula y el medio que la rodea. El modo más simple de aumentar el contraste es
la utilización de colorantes.
Si se desea simplemente aumentar el contraste
de las células para la microscopía, son suficientes los procedimientos que
usan un solo colorante llamados de tinción simple. Sin embargo, a menudo se
utilizan métodos que no tiñen de igual modo a todas las células o a sus
estructuras, es el proceso
denominado tinción compuesta y/o diferencial. Uno muy usado en microbiología es la tinción
de Gram. Basándose en su reacción a la tinción Gram, las bacterías pueden
dividirse en dos grupos: grampositivas y gramnegativas. Esta tinción tiene
gran importancia en taxonomía bacteriana ya que indica diferencias
fundamentales de la pared celular de las distintas bacterias.
Mientras que
las bacterias gramnegativas son constantes en su reacción, los microorganismos
grampositivos pueden presentar respuestas variables en ciertas condiciones
(son gramlábiles). Por ejemplo, los cultivos viejos de algunas bacterias
grampositivas pierden la propiedad de retener el cristal violeta, y en
consecuencia, se tiñen por la safranina apareciendo como gramnegativas.
Análogo efecto se produce en ocasiones por cambio en el medio del organismo, o
por ligeras modificaciones en la ejecución de la técnica. Por este motivo, es
preciso atenerse, en la práctica, al procedimiento establecido.
 
Todo
estudio bacteriológico consta de 3 fases básicas: BACTERIOSCÓPICO,
CULTIVO
Y ANTIBIOGRAMA. En el bacterioscópico, que puede efectuarse con la tinción
Gram, se evalúa la afinidad tintorial de la bacteria así como su
morfología y agrupación. En una muestra recuperada de un paciente es
posible observar, con la tinción de Gram además de bacterias, levaduras,
leucocitos, restos celulares, eritrocitos, etc.
Es importante que el
laboratorio cuente con un control de calidad que le permita ofrecer
seguridad y confiabilidad en su procedimiento, para ello, como controles frotis preparados con las cepas
de referencia:
Escherichia coli
ATCC #25922 (Cocobacilo gram negativo)
Staphylococcus aureus
ATCC #25923 (Coco gram positivo)
 
Aquí puedes ver las diferencias
estructurales y químicas de los dos tipos de pared
bacteriana:
|
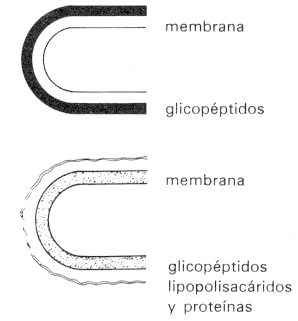 |
Pared Gram + |
|
capa densa y uniforme de
200 a 800 A) |
|
ácidos
teicóicos |
|
polisacáridos |
|
proteínas (pocas
veces) |
|
glucopéptido (50% del peso
seco) |
|
Pared Gram - |
|
capa interna delgada de 20
a 30 A cubierta por capas externas de densidad menor) |
|
lipopolisacáridos |
|
lipoproteínas |
|
proteínas |
|
glucopéptido (10% del peso
seco) |
|
REACTIVOS |
CARACTERÍSTICAS |
|
|
GRAM + |
GRAM - |
|
1) Cristal
violeta |
Células color
violeta |
Células color
violeta |
|
2) Lugol solución
iodada |
Se forma el complejo
CV-I. Las células continúan teñidas de color violeta. |
Se forma el complejo
CV-I. Las células continúan teñidas de color violeta. |
|
3) Alcohol-Cetona |
Se deshidratan las
paredes celulares. Se contraen los poros. Disminuye la
permeabilidad. El complejo CV-I no sale de las células que continúan
teñidas de color violeta. |
Eliminación por
extracción de grasas de las paredes celulares por el solvente. Aumenta la porosidad. El
complejo CV-I se separa de la célula. |
|
4)
Safranina |
Células no decoloradas; teñidas de color violeta. |
Células decoloradas; se tiñen de color
rosado. |
 
Método
a) Extensión:
En un porta bien limpio (con alcohol, papel de filtro y flameado) se coloca
una gota de agua destilada a la que. con el asa de siembra,
previamente esterilizada a la llama, se lleva una pequeña cantidad de suspensión de
bacterias o, en su caso, de una colonia. Con el asa se extiende la
gota y las
bacterias sobre el porta y se fija la extensión por el calor, calentando
suavemente a la llama del mechero hasta que se seque.
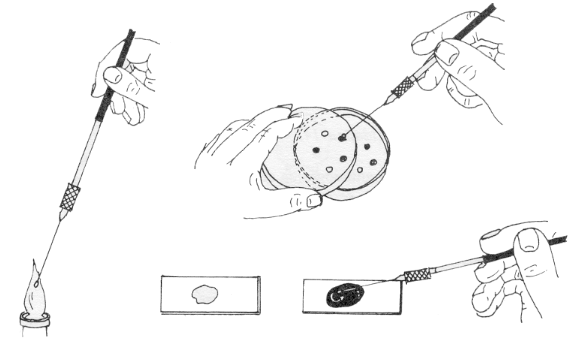
b) Tinción Gram:
|
Coloración
a) 1 minuto en cristal violeta (colorante inicial)
b) se lava con agua destilada
c) 1 minuto en
lugol (mordiente)
d) se decolora con alcohol-Cetona (decolorante)
e) se lava con agua destilada
f) 1 minuto en
safranina (colorante de contraste)
g) se lava con agua corriente
h)
se seca suavemente y sin frotar con papel de filtro |
Observación
Debe utilizarse el objetivo de inmersión
con la técnica adecuada.
Una vez localizado el campo de observación con
el objetivo 10x, se
coloca una gota de aceite de cedro sobre la preparación. Se hace girar el
revólver hasta el objetivo de 100x, enfocando solamente con el micrométrico.
Después de utilizar el objetivo de
inmersión debe limpiarse con xilol o con un paño suave |
|
Tinción Bacteriológica Gram |
|


|
El equipo
para realizar la tinción de gram consta de:
Colorantes: Cristal Violeta, Yodo-Lugol y Safranina.
Solvente: Alcohol-Cetona.
Charola de tinción.
Asa bacteriológica o hisopo.
Piceta o Frasco lavador.
Muestra bacteriana sólida (agar),
líquida (caldo) o especímen clínico.
|
|
  |
Previo.- Preparación de un extendido (seco/húmedo) de la
muestra |
|
 
|
Paso 1.- Cubrir la preparación con
Cristal Violeta por 60 seg y enjuagar suavemente con agua. |
|
  |
Paso 2.-
Cubrir la preparación con Yodo-Lugol por 60 seg y enjuagar suavemente con
agua. |
|

|
Paso 3.-
Cubrir la preparación con Alcohol-Cetona durante algunos segundos (5-10) y
enjuagar suavemente con agua. |
|
  |
Paso 4.-
Cubrir la preparación con Safranina por 30 seg y enjuagar suavemente con
agua. Secar y Observar en 100x (inmersión). |
|
Es
conveniente secar el exceso de agua en el frotis cuidadosamente con un paño
suave o papel desechable para proceder a la observación al microscopio
empleando el objetivo de inmersión |
 
|
|
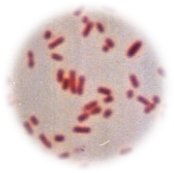
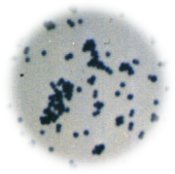
Bacteria
Gramnegativa
   Bacteria
Grampositiva Bacteria
Grampositiva |
  |
