![]()
Selbsthilfegruppe der Amalgam- und Zahnmaterialgeschädigten Kronach
.... aus den USA: Interessante wissenschaftliche Information zur Entgiftung....
N-Acetylcystein als ein Antidot bei Methyl-Quecksilber-Vergiftung
Nazzareno Ballatori,1 Michael W. Lieberman2 und Wei Wang1
1Abteilung
für
Umweltmedizin, Universität Rochester, Medizinische Fakultät,
Rochester, NY 14642 USA
2Abteilungen
für Pathologie und Zellbiologie, Baylor College of Medicine,
Houston, TX 77030 USA
Vorbemerkungen: Methyl-Quecksilber ist ein überall in der Umwelt vorkommendes Belastungs-Agens und ein starkes Nervengift. Die Behandlung von Methyl-Quecksilber-Vergiftungen greift vorwiegend auf Chelatbildner zurück, um die Metallausscheidung zu beschleunigen. Die vorliegende Studie zeigt auf, dass die orale Gabe von N-Acetylcystein (NAC), ein überall verfügbarer und überwiegend ungiftiger Abkömmling von Aminosäuren, bei Mäusen eine ansehnliche Beschleunigung der Methyl-Quecksilber-Ausscheidung über den Urin hervorruft. Mäuse, die NAC im Trinkwasser 48 h nach der Methyl-Quecksilber-Exposition erhielten (10 mg/ml), schieden im Urin in den nächsten 48 h zwischen 47 und 54 % des 203Hg aus im Vergleich zu einer nur 4 bis 10 %-igen Ausscheidung bei Tieren der Kontrollgruppe. Wenn NAC-haltiges Wasser vom Beginn der Methyl-Quecksilber-Exposition an gegeben wurde, erwiesen sich die gesteigerte Ausscheidung von Methyl-Quecksilber und auch das Absinken des Quecksilbergehaltes in den Zellen sogar als noch wirkungsvoller. Im Gegensatz dazu wurde die Ausscheidung von anorganischem Quecksilber durch die orale Gabe von NAC nicht beeinflusst. Die Fähigkeit von NAC, die Ausscheidung von Methyl-Quecksilber zu steigern, wenn es oral gegeben wird, seine relativ niedrige Toxizität und seine breite Verfügbarkeit bei der klinischen Behandlung zeigen an, dass es ein ideales therapeutisches Agens sein kann für den Einsatz bei Methyl-Quecksilber-Vergiftungen.
Schlüsselbegriffe: Antidot, Gehirn, Glutathion, anorganisches Quecksilber, Methyl-Quecksilber, N-Acetylcystein, Vergiftung
Umweltgesundheits-Perspektive: 106:267-271 (1998) . [Online 31 March 1998]
http://ehpnet1.niehs.nih.gov/docs/1998/106p267-271ballatori/ abstract.html
Korrespondenz-Adresse: N. Ballatori, Department of Environmental Medicine, Box EHSC, University of Rochester School of Medicine, 575 Elmwood Avenue, Rochester, NY 14642 USA.
Wir danken Amy L. Wiseman für die Koordination der Mäusebeschaffung, Robert Gelein und Robert J. Baitchman für das Zur-Verfügung-Stellen von Versuchskäfigen, Taft Toribara für die Herstellung und Beschreibung von Methyl-Quecksilber-Chlorid, und Thomas W. Clarkson für die Kaltdampf-Atomabsorptions-Analyse und für das kritische Korrekturlesen dieses Manuskripts. Diese Forschung wurde unterstützt teils durch die National Institutes of Health, die ES06484, ES07827 und DK48823 gewähren, und das NIEHS Center, das ES01247 gewährt.
Erhalten am 21. 10. 1997 ; angenommen am 12. Januar 1998.
Einleitung
Die Belastung des Menschen mit Methyl-Quecksilber geschieht meist durch den Verzehr von Fisch und anderen Meeresprodukten, obgleich sich etliche unbeabsichtigte starke Belastungen auch ereigneten einschließlich einer Epidemie in Japan (Minamata-Krankheit), im Irak, in Pakistan und in Guatemala (1-3). Belastung kann sich auch bei der Forschung ergeben, wie es die kürzliche fatale Vergiftung einer Chemikerin am Dartmouth College unter Beweis stellt (4).
Mit Methyl-Quecksilber vergiftete Individuen zeigen schwerwiegende neurologische Störungen einschließlich Paresthesie, Ataxie, Sinnes- und Sprachbehinderung und Einengung des Gesichtsfeldes (1 - 3). Diese klinischen Symptome kommen nur zum Vorschein nach einer relativ lang andauernden Zeit von 1 – 2 Monaten. Weil der Schaden am Zentralnervensystem irreversibel zu sein scheint, muss die Behandlung sofort nach der Giftaufnahme erfolgen (3, 5). Der einzige Weg, die Giftwirkung zu verhindern oder aufzuhalten, wenn einmal Methyl-Quecksilber aufgenommen wurde, besteht darin, seine Entfernung aus dem Körper zu beschleunigen.
Strategien zur Entfernung des Methylquecksilbers schließen Blutwäsche, Blutaustausch und Chelattherapien mit ein, wobei die letztgenannte Therapie den am wenigsten belastenden und den gebräuchlichsten therapeutischen Eingriff darstellt (3, 5, 6). Obwohl viele Chelatbildner im Verlaufe der letzten 40 Jahre getestet wurden, wurde bis heute kein einziges herausragendes Agens für seinen Einsatz bei Methyl-Quecksilber-Vergiftungen gefunden. Von den Agenzien, die getestet wurden, sind meso-2,3-dimercaptosuccinic acid (DMSA, succimer) und 2,3-dimercapto-1-propanesulfonic acid (DMPS, Dimaval) die effizientesten zur beschleunigten Ausscheidung von Methyl-Quecksilber und zur Verhinderung der Vergiftung sowohl bei Versuchstieren (7 - 16) als auch beim Menschen (5, 6, 17). Jedoch haben diese Agenzien in Lösung eine begrenzte Haltbarkeit, sind für den Einsatz am Menschen nur begrenzt verfügbar und haben die Neigung, andere lebenswichtige und nicht lebenswichtige Metalle zu mobilisieren (18 - 21).
Überraschenderweise wurde bisher der mögliche Einsatz von N-Acetylcystein (NAC) als Chelatbildner für Methyl-Quecksilber nicht erforscht. Diese Unterlassung rührt möglicherweise von drei Faktoren her. Erstens wurde NAC für unwirksam befunden zur beschleunigten Ausleitung von zweiwertigen Metallen, anorganisches Quecksilber eingeschlossen, Hg2+ (22 - 28) und bezüglich der Fähigkeit von NAC, die embryonale Schädigung durch Methyl-Quecksilber induzierte Vergiftung zu verhindern, wurden widersprüchliche Ergebnisse berichtet (29, 30). Zweitens sind strukturmäßig mit NAC verwandte Komponenten wie N-Acetyl-Penicillamin (N-acetyl-ß, ß-dimethylcystein) und Penicillamin selbst nur minimal wirksam bei der Beschleunigung der Methyl-Quecksilber-Ausscheidung (5, 15). Drittens erschien der Nutzen von NAC kontraindiziert zu sein, weil etwas NAC in Cystein umgewandelt wird (31), eine Aminosäure, die im Ruf steht, Methyl-Quecksilber in Richtung Hirn als ihr Ziel verstärkt freizusetzen.
Allerdings war bei zwei Studien, in deren Verlauf NAC in Verbindung mit Blutwäsche bei mit Methyl-Quecksilber verseuchtem Blut eingesetzt wurde, dieser Chelator sehr effektiv bei der verstärkten Aussonderung des Methyl-Quecksilbers aus dem Blut (17, 34). Lund und ihre Mitarbeiter (17) bemerkten bei einem mit Methyl-Quecksilber akut vergifteten Patienten ein schlagartiges Anwachsen der Ausscheidung des Methyl-Quecksilbers im Urin während und ebenso gut nach der Blutwäsche. Diese Forscher legten nahe, dass NAC künftig als mögliches Antidot gegen Methyl-Quecksilber getestet werden sollte. Die vorliegende Studie belegt diese Empfehlung, indem sie nachweist, dass NAC eine dramatische Beschleunigung der Ausleitung von Methyl-Quecksilber erreicht, wenn es Mäusen oral gegeben wird.
Experimentelle Vorgehensweisen:
Methyl-Quecksilberchlorid wurde von ICN bezogen (Plainsville, NY), und 203HgCl2 wurde erworben von
Amersham Corporation (Arlington Heights, IL). CH3203HgCl wurde synthetisch hergestellt aus 203HgCl2 nach der Methode von Toribara (35). Wir konnten die Reinheit des synthetischen 203HgCl2 bestätigen durch die Verwendung der Kalt-Dampf-Atom-Absorption (36). Das Produkt enthielt weniger als 1 % anorganische Quecksilber-Verunreinigung. NAC wurde von der Sigma Chemical Company (St. Louis, MO) bezogen. Es wurde in Wasser gelöst, der pH-Wert auf 6,7 – 6,8 eingestellt durch Zugabe von 5 M NaOH und auf eine Endkonzentration von 10 mg/ml verdünnt. Wir bereiteten alle 2 – 3 Tage frische NAC -Lösungen zu.
Weibliche und männliche C57Bl/6 Mäuse (15 - 26 g, 8 Wochen alt) erhielten wir vom Jackson Laboratorium in Bar Harbor, Maine, und vom Baylor College of Medicine, Houston, Texas. Die Tiere wurden fortlaufend in einem Purina Mills Labor ernährt und mit beliebig viel Wasser in einem temperaturgesteuerten Raum mit einem 12 Stunden-Hell-Dunkel-Zyklus gehalten. Die Experimente wurden entsprechend den Richtlinien des National Institutes of Health for care of laboratory animals durchgeführt.
Die Mäuse wurden individuell in Edelstahl-Futterkäfigen untergebracht (Lab Products Inc., Rochelle Park, NJ) und es wurde ihnen gestattet, sich über 3 – 4 Tage an die Käfige zu gewöhnen. Urin und Stuhl wurden auf plastikbegrenzten Saugpapieren gesammelt, die unterhalb jedes Käfigs angebracht waren. Stuhl wurde von dem mit Urin getränkten Papier getrennt, und beide Exkremente wurden in je einer kleinen Plastikbox gestapelt. Einigen Mäusen wurde NAC in ihrem Trinkwasser 48 Stunden vor der Quecksilbergabe verabreicht. Die Mäuse wurden intraperitonal mit 203Hg- beschriftetem Methylquecksilberchlorid (0,5 oder 25 µmol/kg Körpergewicht) oder 203HgCl2 (0,5 µmol/kg, ip) injiziert. Die Injektionslösungen wurden in Krebs-Henseleit- Bufferlösung vorbereitet und in einer Menge von 10 ml/kg Körpergewicht verabreicht (20 µCi/kg). Körperbelastung, Urin- und Stuhlgehalt an 203Hg wurden täglich mit einem Gammazähler Modell 3002 von Packard gemessen. Wir zählten 203Hg –Standards täglich, die wir mit den Lösungen vorbereitet hatten, mit dem gleichen Instrument, um die Abweichung und die Zählerzuverlässigkeit zu korrigieren.
Nach 5 Tagen wurden die Mäuse mit Sodium Pentobarbital betäubt (55 mg/kg; ip) und ausgewählte Gewebe entnommen zur Glutathion- (GSH) und 203Hg-Analyse (Leber, Nieren, Gehirn, das gesamte Blut). Die Tiere wurden getötet nach 1300 bis 1600 Stunden. Das gesamte Blut wurde aus der Vena Cava im Bauchraum herausgezogen. Gewebeproben der Leber, einer Niere, des Gehirns und 0,2 bis 0,3 ml des Gesamtblutes wurden jeweils in abgewogene Glaszylinder verbracht, die jeweils 5 ml einer 2,5 %-igen Sulfonsalicylsäure pro 0,25 mM Acivicin zur anschließenden GSH-Bestimmung enthielten, wie es zuvor beschrieben wurde (37). Wir zählten jede der Hirn- und Blutproben unter Benutzung eines Packard Gammazählers Modell 3002 jeweils 30 sec lang und homogenisierten dann die Proben. Leber- und Nierenproben wurden entfernt, gewogen und zur 203Hg-Bestimmung verwendet. Zur Analyse des NAC-Gehaltes wurde Urin mit Hilfe von 1-ml Syringen und 27-er Standardnadeln aus den Harnblasen einiger Tiere gezogen. Die Urinproben wurden mit Dithiothreitol behandelt um die Disulfid-Bindungen zu reduzieren, eine Ableitung mit 1-Fluor-2,4-Dinitro-benzen (38) gebildet und dann das NAC unter Verwendung eines HPLC-Protokolls wie vorher beschrieben (39) analysiert.
Ergebnisse:
Männliche und weibliche C57Bl/6 Mäuse, die akut mit CH3203HgCl (0,5 µmol/kg Körpergewicht) behandelt waren, schieden 59 % bzw. 28 % der Dosis binnen 5 Tagen aus, siehe Schaubild 1. Dieses Ergebnis korrespondiert mit einer Halbwertzeit von nahezu 4 Tagen bei männlichen und 9 Tagen bei weiblichen Tieren. Die Werte sind vergleichbar denen, die in früheren Studien mit Mäusen angegeben wurden (9, 13). Die Ausscheidung von 203Hg über den Urin war annähernd dreimal so hoch bei männlichen Tieren (Schaubild 3A), wohingegen die Ausscheidung über den Stuhl bei männlichen und weiblichen Tieren gleich war (Schaubild 2B).
B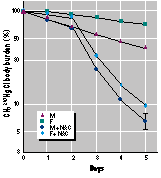 ild
1:
ild
1:
Die Körperbelastung mit 203Hg benanntem Methyl-Quecksilber in männlichen (M) und weiblichen (F) C57B1/6- Mäusen, denen intraperitonal 0,5 µmol CH3203HgCl pro kg Körpergewicht injiziert wurde. Nach 48 Stunden erhielten einige Mäuse N-Acetylcystein (NAC) im Trinkwasser (10 mg/ml). Die Werte repräsentieren unter Berücksichtigung der Standardabweichung 4 bis 5 Mäuse je Gruppe (bei den meisten Werten sind die Fehlerwerte stets kleiner als das Symbol).
Bi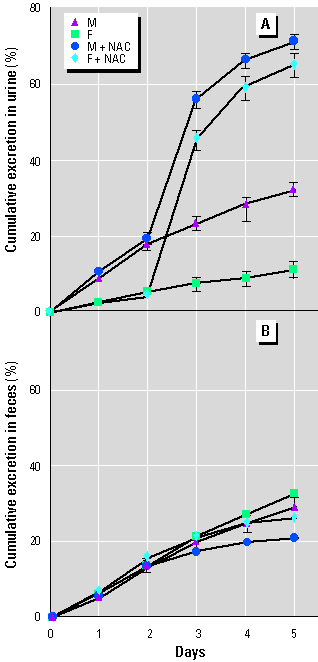 ld
2:
ld
2:
Sammelurin- (A) und Faeces-Ausscheidung (B) von 203Hg bei männlichen (M) und weiblichen (F) Mäusen, die 0,5 µmol CH3203HgCl pro kg Körpergewicht erhielten.
Nach 48 h erhielten einige Mäuse N-Acetylcystein (NAC) im Trinkwasser (10 mg/ml). Die Werte beziehen sich auf 4 bis 5 Mäuse je Gruppe unter Berücksichtigung der ± Standardabweichung.
Im Gegensatz zu der relativ geringen Ausschei-dungsrate bei den Kontrolltieren schieden Mäuse, die NAC im Trinkwasser 48 h nach der Methylquecksilbergabe erhalten hatten, 91 bis 94 % der Dosis im Verlaufe der gleichen Zeit aus. (Bild 1) Das meiste Methylquecksilber wurde im Urin ausgeschieden (Bild 2A). NAC hatte keine Auswirkung auf die fäkale 203Hg-Ausscheidung. (Bild 2B)
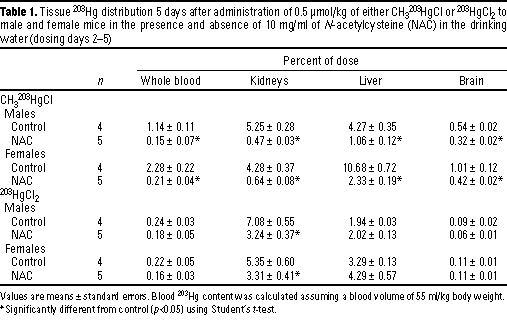
NAC mobilisierte wirkungsvoll das Methylquecksilber aus allen untersuchten Geweben einschließlich des Hirns (Tabelle 1). Der 203Hg-Gehalt des Blutes, der Nieren und der Leber betrug bei den Mäusen, die NAC erhalten hatten, näherungsweise 10 bis 20 % des Wertes der Kontrolltiere, wohingegen die Hirnwerte etwa um die Hälfte abgenommen hatten im Vergleich zu den Kontrolltieren (Tab 1). Mäuse,
die NAC im Trinkwasser vom Beginn der Me-thylquecksilbergabe an erhalten hatten, zeigten eine noch dramatischere Beschleunigung der 203Hg-Ausscheidung bezogen auf ihre Ganzkörperbelastung (Bild 3) und ihre Urinausscheidung (Bild 4A). Diese Tiere sonderten 87 % der Methylquecksilber-Dosis in nur 2 Tagen aus (Bild 3). Wenn umgekehrt das NAC aus dem Trinkwasser entfernt wurde, stellte sich ein abrupter Abfall der Methylquecksilber-Ausscheidung ein (Bild 3). Die biologische Halbwertszeit für Methylquecksilber nach Absetzen der NAC-Gabe ähnelte derjenigen von Mäusen, die kein NAC erhalten hatten. Das ist an der Neigung der Linie abschätzbar.
Bi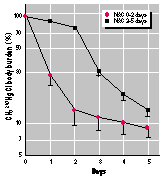 ld
3:
ld
3:
Körperbelastung durch 203Hg-benanntes Methylquecksilber bei weiblichen Mäusen, denen intraperitonal 0,5 µmol CH3203HgCl pro kg Körpergewicht injiziert wurde.
Eine Gruppe der Mäuse erhielt NAC im Trinkwasser (10 mg/ml) in den ersten 48 h nach der Methylquecksilbergabe, wohingegen die andere Gruppe NAC im Trinkwasser erst 2 bis 5 Tage nach der Injektion erhielt. Die Werte beziehen sich auf 5 Mäuse je Gruppe unter Berücksichtigung der Standardabweichung.
Bild 4:
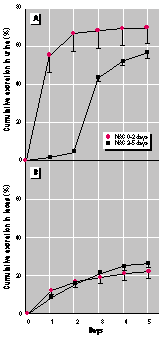 Sammelurin-
(A) und Fäkalausscheidung (B) von 203Hg
bei Mäusen, die 0,5 µmol CH3203HgCl
pro kg Körpergewicht erhalten hatten. Eine Mäusegruppe erhielt NAC
im Trinkwasser binnen 48 h nach der Methylquecksilbergabe (10 mg/ml).
Dagegen erhielt die andere Mäusegruppe erst 2 bis 5 Tage danach NAC
im Trinkwasser. Die Werte beziehen sich auf 5 Mäuse je Gruppe unter
Berücksichtigung der Standardabweichung.
Sammelurin-
(A) und Fäkalausscheidung (B) von 203Hg
bei Mäusen, die 0,5 µmol CH3203HgCl
pro kg Körpergewicht erhalten hatten. Eine Mäusegruppe erhielt NAC
im Trinkwasser binnen 48 h nach der Methylquecksilbergabe (10 mg/ml).
Dagegen erhielt die andere Mäusegruppe erst 2 bis 5 Tage danach NAC
im Trinkwasser. Die Werte beziehen sich auf 5 Mäuse je Gruppe unter
Berücksichtigung der Standardabweichung.
NAC erwies sich auch als wirksam bei Mäusen, denen eine 50fach höher Dosis von Methylquecksilberchlorid verabreicht wurde (25 µmol/kg Körpergewicht) (Bild 5). Diese Dosis liegt an der Grenzschwelle der Toxizität bei Mäusen (16). Aber bei dieser Studie wurden keinerlei klinische Anzeichen der Toxizität festgestellt. Die Ergebnisse mit der Höherdosierung waren vergleichbar den Niedrigdosierungen mit der Ausnahme, dass die biologische Halbwertszeit ein wenig länger ausfiel (vergleiche Bilder 3 und 5). Kontrolltiere schieden 16 % der Methylquecksilberdosis in den ersten 2 Tagen aus. Im Gegensatz dazu schieden Mäuse, die NAC im Trinkwasser erhielten, in den ersten 2 Tagen 75 % der Methylquecksilberdosis aus (Bild 5). Wenn NAC erst zwei Tage nach der Methylquecksilbergabe gegeben wurde, fand ein abrupter Anstieg der 203Hg-Ausscheidung statt. Die Körperbelastung nahm von 84% auf 16 % der Originaldosis binnen 3 Tagen ab. (Bild 5). Entzog man das NAC wieder, kehrte die biologische Halbwertszeit des Methylquecksilbers zu den Werten zurück, die bei den Kontrolltieren beobachtet wurde (Bild 5).
Bi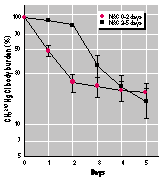 ld
5:
ld
5:
Körperbelastung mit Methylquecksilber bei weiblichen Mäusen, denen intraperitonal 25 µmol CH3203HgCl pro kg Körpergewicht injiziert wurde. Eine Gruppe der Mäuse erhielt N-Acetylcystein (NAC) im Trinkwasser binnen 48 h nach der Injektion (10 mg/ml). Dagegen erhielt die andere Mäusegruppe NAC im Trinkwasser erst vom 2. bis zum 5. Tag danach. Die Werte zeigen 5 Mäuse je Gruppe unter Berücksichtigung der Standardabweichung.
Im Gegensatz zur Methylquecksilber-Ausscheidung fand die Absonderung von anorganischem Quecksilber hier schneller statt (a t1/2 in weniger als 2 Tagen) und wurde nicht vom NAC ausgelöst (Bild 6). Allerdings war eine signifikante Umverteilung des 203Hg im Gewebe von Tieren zu beobachten, die das NAC erhalten hatten (Tabelle 1). Das kann auf einen Verlusteffekt bei der Ganzkörperausscheidung von anorganischem Quecksilber zurückzuführen sein. Die 203Hg-Werte im Nierengewebe waren niedriger bei Mäusen, die NAC erhalten hatten (Tabelle 1). Diese Umverteilung weg von den Nieren (die schätzungsweise ein Drittel der Ganzkörperbelastung enthalten) kann die Quecksilbermenge begrenzen, die über den Urin ausgeschieden werden kann.
B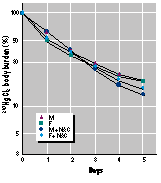 ild
6:
ild
6:
Körperbelastung durch anorganisches Quecksilber bei männlichen (M) und weiblichen (F) Mäusen, denen intraperitonal 0,5 µmol 203HgCl2 pro kg Körpergewicht injiziert wurde.
Nach 48 Stunden erhielten einige Mäuse N-Acetylcystein (NAC) in ihrem Trinkwasser (10 mg/ml). Die Werte beziehen sich auf 4 bis 5 Mäuse je Gruppe unter Berücksichtigung der Standardabweichung.
Auch der Glutathionspiegel in Leber, Niere, Hirn und im gesamten Blut wurde bei der Obduktion gemessen. Dabei wurden keinerlei Unterschiede zwischen NAC- behandelten Mäusen und der Kontrollgruppe festgestellt (auf die Darstellung der Daten wurde deshalb verzichtet).
Folglich lässt zusätzliches Cystein – obwohl etwas NAC in Cystein umgewandelt wird (31) – die GSH-Werte im Gewebe bei Mäusen nicht ansteigen, wenn sie ad libitum gefüttert werden.
Die Analyse von Urinproben, die im Verlaufe der Obduktion aus der Harnblase gesammelt wurden, zeigten hohe Konzentrationen an NAC: 10,5 ± 1,5 mM (Bereich von 6 - 18 mM, n = 7) bei Mäusen, die in ihrem Trinkwasser NAC erhalten hatten.
Diskussion
Zurzeit gibt es keine effektive Strategie, die eine schnelle Ausleitung von Methylquecksilber bei vergifteten Individuen bewerkstelligt. Eine Anzahl von Komplexmitteln, die Sulfhydril enthalten, wurde gründlich getestet und für nur begrenzt wirksam befunden (7 – 17). Im Gegensatz dazu demonstriert die vorliegende Studie, dass NAC ein ideales Therapeutikum sein kann für den Einsatz bei Methylquecksilber-Vergiftung. NAC ist ein Aminosäure-Derivat, das in der klinischen Medizin häufig eingesetzt wird. Es ist für den Menschen nicht toxisch und es wird sehr schnell über den Urin ausgeschieden. Diese rapide Urinausscheidung von NAC erklärt am besten seine Fähigkeit, die Ausscheidung von Methylquecksilber über den Urin zu bewerkstelligen.
Ein anderes Cystein-Derivat, das D-Penicillamin, war eines der frühesten Mittel, das man zur Ausleitung von Methylquecksilber über den Urin gefunden hatte (7). Jedoch bewiesen Folgestudien, dass Verbindungen, die zwei Thiol-Gruppen enthielten wie DMSA und DMPS, bei der Mobilisierung von Methylquecksilber aus verschiedenen Gewebepartien und beim In-Gang-Setzen ihrer Ausleitung aus dem Körper effektiver als D-Penicillamin waren (8 – 17). Gabard (11) und Magos (9) berichteten, dass DMSA effektiv die Körperbelastung und die Quecksilber-Konzentration aus Gehirn, Blut, Leber und Nieren von Ratten und Mäusen absenkt, die vorher mit Methylquecksilberchlorid behandelt wurden. Aaseth und Friedheim (13) verglichen die Effekte von 5 verschiedenen Chelatbildnern bei mit Methylquecksilber vergifteten Mäusen (DMSA, DMPS, N-acetyl-d, l-penicillamin, mercaptosuccinic acid und mercaptostarch). Sie fanden auch heraus, dass DMSA hervorragend geeignet war bei der Beschleunigung der Ganzkörper-Ausscheidung und beim Absenken der Gewebebelastung. DMSA steigerte die Menge des mit dem Urin ausgeschiedenen Quecksilbers von 15 % der Dosis bei den Mäusen der Kontrollgruppe bis auf 62 % bei Mäusen, die DMSA (dimercaptosuccinic acid) 8 Tage lang in ihrem Futter erhalten hatten (13). Bei Menschen, die mit Methylquecksilber kontaminiertes Brot verzehrt hatten, war DMPS effektiver als D-Penicillamin oder N-acetyl-d, l-penicillamin hinsichtlich des Absenkens der Quecksilberwerte im Blut (5). DMPS war auch mittelmäßig wirksam bei der Absenkung des Quecksilberspiegels im Blut im Falle einer akuten Methylquecksilbervergiftung. (17). Weil Methylquecksilber eine extensive enterohepatische Umschichtung erfährt, wurde auch ein nicht absorbierbares Thiol-haltiges Harz erfolgreich eingesetzt, um das Quecksilber zu binden, das über die Galle ausgeschieden wurde und die Ausscheidung über den Stuhl beschleunigte. Bei Menschen senkte dieses Harz die durchschnittliche Ausscheidungs-Halbwertszeit für Methylquecksilber im Blut von 65 auf 20 Tage (5). Wegen dieser frühen Befunde mit Dithiol- und Polythiolkomponenten wurden die meisten Folgebemühungen zum Identifizieren von Gegengiften (Antidots) zu Methylquecksilber auf diese Klasse von Chelatbildnern fokussiert.
Die vorliegende Studie demonstriert, dass NAC gegenüber vorher getesteten Komplexmitteln überlegen sein kann. NAC setzte eine dramatische Beschleunigung der Methylquecksilber-Entfernung in Gang, wobei das meiste Quecksilber über den Urin ausgeschieden wurde. Nahezu 90 % der verabreichten Dosis wurde binnen nur 2 Tagen entfernt, wenn die Mäuse fortlaufend NAC in ihrem Trinkwasser erhielten (Bild 3). Diese Ausscheidungsrate liegt höher als in allen früher vorgelegten Studien. Die Ausscheidung von Methylquecksilber wurde auch beschleunigt, wenn NAC erst 2 Tage nach der Methylquecksilber-Exposition verabreicht wurde, was auf eine wirksame Mobilisation aus Gewebepartien hinweist. Von Bedeutung ist auch, dass Hirnbelastungen bei NAC- behandelten Tieren niedriger wurden, was eine wirksame Mobilisation aus dem Zielorgan beweist. Die Mobilisation aus dem Gehirn war jedoch niedriger als aus anderen Organen (Tabelle 1).
NAC ist nicht toxisch und wird klinisch fortlaufend als Schleimlöser und bei der Behandlung einer Überdosierung mit Acetaminophen verwendet (40, 41). Es ist überall verfügbar, relativ preisgünstig, leicht einsetzbar und wird von den Patienten gut vertragen. Die klinische Pharmakologie von NAC ist gut dokumentiert
(42 – 45). Es hat ein Handelsvolumen von 0,33 l/kg, was seine Verteilung hauptsächlich im extrazellulären Wasser anzeigt. Es wird sehr schnell über den Urin ausgeschieden, wobei näherungsweise ein Drittel in den ersten 12 Stunden nach der Verabreichung mit dem Urin abgesondert wird (42). Im Urin liegt es meist als symmetrisches Disulfid oder als mit Cystein gemischtes Disulfid vor, obgleich es genau so gut als freies Thiol ausgeschieden wird (46, 47). Beim Menschen beträgt die biologische Halbwertszeit (t1/2) für NAC im Blutplasma annähernd 2 Stunden (42 – 45). Diese kurze Halbwertszeit steht im Einklang mit der rapiden Beschleunigung der Methylquecksilber-Ausscheidung, die während der NAC-Gabe beobachtet wird, aber auch mit der rapiden Verringerung der Methylquecksilber-Ausscheidung nach Absetzen des NAC (Bilder 1, 3 und 5).
 I
I
Im Unterschied zu einigen Dithiol-Komplexmitteln (18 – 21) verändert NAC nicht die Gewebeverteilung der lebenswichtigen Metalle (Spurenelemente) (48). Hjortso et. al. (48) bestimmten Plasma und Urinkonzentration von Spurenelementen (Ca, Mg, Fe, Zn, and Cu) bei gesunden Versuchspersonen, die 2 Wochen lang mit NAC behandelt wurden, und fanden dabei keine signifikante Änderung der Plasmakonzentration oder der Ausscheidung dieser essentiellen Metalle. Dieser Wirkungsmangel des NAC auf endogene zweiwertige Metallionen ist vereinbar mit seiner relativ niedrigen intrinsischen Toxizität und deutet darauf hin, dass es auf einwertige Metalle oder Metallkomponenten wie Methylquecksilber selektiver wirkt.
Bedeutsam ist der Hinweis, dass oral verabreichtes NAC wirkungsvoll war bei der Steigerung der Methylquecksilber-Ausscheidung. Die orale Gabe erleichtert wesentlich die Einsetzbarkeit der Droge bei vergifteten Individuen, sei es beim klinischen Einsatz oder im Alltag. Zusatzstudien sind nötig, um herauszufinden, ob die intravenöse Gabe NAC noch effektiver machen könnte. Zusatzstudien sind auch nötig, um die Wirksamkeit von NAC nach chronischer Methylquecksilbervergiftung zu testen und zu bestimmen, ob eine Reduktion der Gewebebelastung in der Lage ist, durch Methylquecksilber bedingte funktionelle Störungen umzukehren.
Im Gegensatz zur Ausscheidung von Methylquecksilber wurde die Reinigung von anorganischem Quecksilber durch NAC nicht beschleunigt (Bild 6). Ähnliche Ergebnisse wurden schon früher mitgeteilt (22). Die mangelhafte Wirksamkeit bei der Ausscheidung von metallischem Quecksilber überrascht nicht, verfolgt man die Spur dieses NAC-Mangels in Richtung der zweiwertigen Metallionen in der Homeostase (=Gleichgewicht der physiologischen Körperfunktionen) (siehe oben). NAC hat auch nur relativ beschränkte Wirksamkeit bei der Ausleitung einer Anzahl anderer exogener Metalle (25 – 28). So könnte NAC relativ beschränkt bei Methylquecksilber Verwendung finden. Sein Nutzen als Antidot sollte im klinischen Einsatz erprobt werden.
Referenzen - Literaturhinweise
1. Bakir F, Damluji SF, Amin-Zaki L, Murtadha M, Khalidi A, al-Rawi NY, Tikriti S, Dahahir HI, Clarkson TW, Smith JC, et al. Methylmercury poisoning in Iraq. Science 181:230-241 (1973).
2. Harada M. Minamata disease: methylmercury poisoning in Japan caused by environmental pollution. Crit Rev Toxicol 25:1-24 (1995).
3. Elhassani SB. The many faces of methylmercury poisoning. J Toxicol Clin Toxicol 19:875-906 (1982).
4. Holden C. Death from lab poisoning. Science 276:1797 (1997).
5. Clarkson TW, Magos L, Cox C, Greenwood MR, Amin-Zaki L, Majeed MA, Al-Damluji SF. Tests of efficacy of antidotes for removal of methylmercury in human poisoning during the Iraq outbreak. J Pharmacol Exp Ther 218:74-83 (1981).
6. Al-Abbasi AH, Kostyniak PJ, Clarkson TW. An extracorporeal complexing hemodialysis system for the treatment of methylmercury poisoning. III. Clinical Applications. J Pharmacol Exp Ther 207:249-254 (1978).
7. Ishihara N, Shiojima S, Suzuki T. Selective enhancement of urinary organic mercury excretion by d-penicillamine. Br J Ind Med 31:245-249 (1974).
8. Friedheim E, Corvi C. Meso-dimercaptosuccinic acid, a chelating agent for the treatment of mercury poisoning. J Pharm Pharmacol 27:624-626 (1975).
9. Magos L. The effects of dimercaptosuccinic acid on the excretion and distribution of mercury in rats and mice treated with mercuric chloride and methylmercury chloride. Br J Pharmacol 56:479-484 (1976).
10. Magos L, Clarkson TW. The effect of oral doses of a polythiol resin on the excretion of methylmercury in mice treated with cysteine, d-penicillamine or phenobarbitone. Chem Biol Interact 14:325-335 (1976).
11. Gabard B. Improvement of oral chelation treatment of methyl mercury poisoning in rats. Acta Pharmacol Toxicol 39:250-255 (1976).
12. Aaseth J. Mobilization of methylmercury in vivo and in vitro using N-acetyl-dl-penicillamine and other complexing agents. Acta Pharmacol Toxicol 39:289-301 (1976).
13. Aaseth J, Friedheim EAH. Treatment of methyl mercury poisoning in mice with 2,3-dimercaptosuccinic acid and other complexing thiols. Acta Pharmacol Toxicol 42:248-252 (1978).
14. Zimmer LJ, Carter DE. The efficacy of 2,3-dimercaptopropanol and d-penicillamine on methyl mercury induced neurological signs and weight loss. Life Sci 23:1025-1034 (1978).
15. Planas-Bohne F. The influence of chelating agents on the distribution and biotransformation of methylmercuric chloride in rats. J Pharmacol Exp Ther 217:500-504 (1981).
16. Domingo JL. Prevention by chelating agents of metal-induced developmental toxicity. Reprod Toxicol 9:105-113 (1995).
17. Lund ME, Clarkson TW, Berlin M. Treatment of acute methylmercury ingestion by hemodialysis with N-acetylcysteine (MucomystR) infusion and 2,3-dimercaptopropane sulfonate. Clin Toxicol 22:31-49 (1984).
18. Cantilena LR, Klaassen CD. The effect of chelating agents on the excretion of endogenous metals. Toxicol Appl Pharmacol 63:344-350 (1982).
19. Kostyniak PJ, Soifer AI. A methylmercury toxicity model to test for possible adverse effects resulting from chelation therapy. J Appl Toxicol 4:206-210 (1984).
20. Aposhian HV, Maiorino RM, Gonzalez-Ramirez D, Zuniga-Charles M, Xu Z, Hurlbut KM, Junco-Munoz P, Dart RC, Aposhian MM. Mobilization of heavy metals by newer, therapeutically useful chelating agents. Toxicology 97:23-38 (1995).
21. Ewan KB, Pamphlett R. Increased inorganic mercury in spinal motor neuron following chelating agents. Neurotoxicology 17:343-349 (1996).
22. Ottenwalder H, Simon P. Differential effect of N-acetylcysteine on excretion of the metals Hg, Cd, Pb and Au. Arch Toxicol 60:401-402 (1987).
23. Henderson P, Hale TW, Shum S, Habersang RW. N-Acetylcysteine therapy of acute heavy metal poisoning in mice. Vet Hum Toxicol 27:522-525 (1985).
24. Girardi G, Elias MM. Effectiveness of N-acetylcysteine in protecting against mercuric chloride-induced nephrotoxicity. Toxicology 67:155-164 (1991).
25. Lorber A, Baumgartner WA, Bovy RA, Chang CC, Hollcraft R. Clinical application for heavy metal-complexing potential of N-acetylcysteine. J Clin Pharmacol 13:332-336 (1973).
26. Shum S, Skarbovig J, Habersang R. Acute lethal arsenic poisoning in mice: effect of treatment with N-acetylcysteine, d-penicillamine, and dimercaprol on survival time. Vet Hum Toxicol 23(Suppl. 1):39-42 (1981).
27. Godfrey NF, Peter A, Simon TM, Lorber A. Intravenous N-acetylcysteine treatment of hematologic reactions to chrysotherapy. J Rheumatol 9:519-526 (1982).
28. Banner W, Koch M, Capin DM, Hopf SB, Chang S, Tong TG. Experimental chelation therapy in chromium, lead, and boron intoxication with N-acetylcysteine and other compounds. Toxicol Appl Pharmacol 83:142-147 (1986).
29. Endo A, Watanabe T. Analysis of protective activity of N-acetylcysteine against teratogenicity of heavy metals. Reprod Toxicol 2:141-144 (1988).
30. Ornaghi F, Ferrini S, Prati M, Giavini E. The protective effects of N-acetyl-l-cysteine aginst methyl mercury embryotoxicity in mice. Fundam Appl Toxicol 20:437-445 (1993).
31. Sheffner AL, Medler EM, Bailey KR, Gallo DG, Mueller AJ, Sarett HP. Metabolic studies with acetylcysteine. Biochem Pharmacol 15:1523-1535 (1966).
32. Hirayama K. Effects of combined administration of thiol compounds and methylmercury chloride on mercury distribution in rats. Biochem Pharmacol 34:2030-2032 (1985).
33. Kerper LE, Ballatori N, Clarkson TW. Methylmercury transport across the blood-brain barrier by an amino acid carrier. Am J Physiol 262:R761-R765 (1992).
34. Kostyniak PJ, Clarkson TW, Cestero RV, Freeman RB, Abbasi AH. An extracorporeal complexing hemodialysis system for the treatment of methylmercury poisoning. I. In vitro studies of the effects of four complexing agents on the distribution and dialyzability of methylmercury in human blood. J Pharmacol Exp Ther 192:260-269 (1975).
35. Toribara TY. Preparation of CH3203HgCl of high specific activity. Int J Appl Radiat Isotope 36:903-904 (1985).
36. Magos L, Clarkson TW. Atomic absorption determination of total, inorganic, and organic mercury in blood. J Assoc Anal Chem 55:966-971 (1972).
37. Tietze F. Enzymic method for quantitative determination of nanogram amounts of total and oxidized glutathione: application to mammalian blood and other tissues. Anal Biochem 27:502-522 (1969).
38. Lewis PA, Woodward AJ, Maddock J. High-performance liquid chromatographic assay for N-acetylcysteine in plasma and urine. J Pharm Sci 73:996-998 (1984).
39. Hinchman CA, Matsumoto H, Simmons TW, Ballatori N. Intrahepatic conversion of a glutathione conjugate to its mercapturic acid. J Biol Chem 266:22179-22185 (1991).
40. Sheffner AL. The reduction in vitro in viscosity of mucoprotein solutions by a new mucolytic agent N-acetyl-l-cysteine. Ann NY Acad Sci 106:298-310 (1983).
41. Prescott LF, Illingworth RN, Critchley JAJH, Stewart MJ, Adam RD, Proudfoot AT. Intravenous N-acetylcysteine: the treatment of choice for paracetamol poisoning. Br Med J 2:1097-1100 (1979).
42. Borgstrom L, Kagedal B, Paulsen O. Pharmacokinetics of N-acetylcysteine in man. Eur J Clin Pharmacol 31:217-222 (1986).
43. Rodenstein D, De Coster A, Gazzaniga A. Pharmacokinetics of oral acetylcysteine: absorption, binding and metabolism in patients with respiratory disorders. Clin Pharmacokinet 3:247-254 (1978).
44. Bonanomi L, Gazzaniga A. Toxicological, pharmacokinetic and metabolic studies on acetylcysteine. Eur J Respir Dis 61(suppl 111):45-51 (1980).
45. Morgan LR, Holdiness MR, Gillen LE. N-Acetylcysteine: its bioavailability and interaction with ifosfamide metabolites. Semin Oncol 10(suppl 1):56-61 (1983).
46. Shih VE, Schulman JD. N-Acetylcysteine-cysteine disulfide excretion in the urine following N-acetylcysteine administration. J Pediatr 74:129-131 (1969).
47. Hannestad U, Sorbo B. Determination of 3-mercaptolactate and N-acetylcysteine in urine by gas chromatography. Clin Chim Acta 95:189-200 (1979).
48. Hjortso E, Fomsgaard JS, Fogh-Andersen N. Does N-acetylcysteine increase the excretion of trace metals (calcium, magnesium, iron, zinc and copper) when given orally? Eur J Clin Pharmacol 39:29-31 (1990).
Letztes Update: 31. März 1998
Übersetzung und Copyright:
Eduard Hauck, Jakobsberg 2, 96332 Rothenkirchen