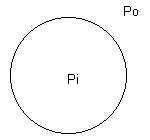

Como la superficie siempre está tratando de alcanzar un mínimo, la presión interna tiene que aumentar para compensar.
La energía libre total de superficie de una burbuja será:
Gs = γ4πr²
Calculando la variación con respecto al radio:
dGs = γ8πr dr
ΔP4πr² dr = 8πrγ dr
ΔP = (2γ/r)
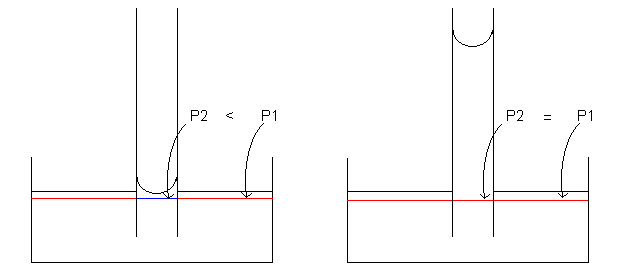
Esto significa que a través de una interfase curva existe una diferencia de presión. Debido a esto, si ponemos un líquido dentro de un capilar de sección circular, y además el líquido moja las paredes del capilar, se creará una superficie curva, por lo tanto, existirá una diferencia de presión. Esta vez, la diferencia de presión será entre la presión atmosférica y la presión hidrostática dentro del líquido.
La ecuación de Laplace explica el fenómeno de ascenso
capilar: dado que a través de la superficie curva del menisco hay
una caída de presión, se produce un ascenso del líquido
hasta que el peso contenido en la columna equilibra la caída de
presión.
demuestre que:
(dV/dA)P, T = (dγ/dP)T, A
pista: la deducción es similar a la de las relaciones de Maxwell.
sustituya en la relación de derivadas parciales mencionada en
la primera parte de este problema y obtenga la ecuación de Laplace.
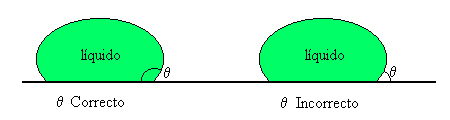
El ángulo de mojado se define como el ángulo de contacto mínimo necesario para que un líquido moje. Un ángulo de contacto igual a 0° significaría mojado perfecto, mientras que si el ángulo fuera igual a 180° el líquido no moja en absoluto. Normalmente se considera que si un ángulo es < 90°, el líquido moja.
Ahora podemos tratar de racionalizar diversos valores de tensiones superficiales
con base en las interacciones a nivel molecular que ya conocemos:
| Líquido | Tensión superficial
(dinas/cm) |
P. de ebull.
(°C) |
Peso molecular |
|---|---|---|---|
| Perfluoroheptano | 10.98 | 82 | 388 |
| Heptano | - | 98 | 100 |
| n-octano | 21.80 | 125.6 | 114 |
| Etanol | 22.75 | 78.5 | 46 |
| CCl4 | 26.77 | 76.7 | 154 |
| Benceno | 28.88 | 80.1 | 78 |
| Agua | 72.75 | 100 | 18 |
Adaptado de: Adamson, A. W. A Textbook of Physical Chemistry Academic Press, Inc.:New York, 1973. Todas las tensiones superficiales e índices de refracción medidos a 20 °C
De la tabla, podemos ver que existe una correlación débil entre la tensión superficial y el punto de ebullición. El que la correlación no sea fuerte se debe a que el punto de ebullición depende de factores que tienen poca influencia sobre la tensión superficial, como el peso molecular y la forma de la molécula (más ramificaciones implican una molécula más esférica, por tanto, una menor área superficial para interactuar y probablemente a una disminución de la energía almacenada en los momentos de inercia).
De cualquier modo, vemos que el compuesto con interacciones intermoleculares
más débiles (perfluoroheptano) es el que presenta la menor
tensión superficial, mientras que el líquido más asociado
(el agua) es el que presenta el mayor valor de la tabla. Es interesante
ver el caso del etanol. El etanol es capaz de formar puentes de hidrógeno,
como el agua; y también posee una parte hidrocarbonada, similar
al octano. Es muy instructivo ver que la tensión superficial del
etanol es mucho más parecida a la del octano que a la del agua.
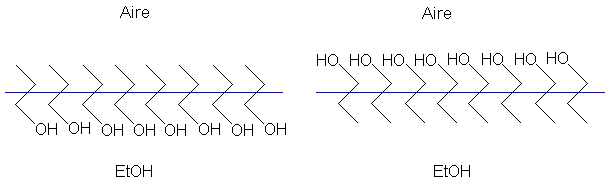
Una explicación posible es que las moléculas del etanol se
encuentran orientadas en la superficie con el extremo hidrocarbonado hacia
el aire, como se muestra en la parte izquierda de la figura, en lugar de
tener el extremo hidroxilado hacia el exterior:
Encargado de la página: Dr. Víctor Manuel Rosas García.
e-mail:[email protected]
Facultad de Ciencias Químicas
Universidad Autónoma de Nuevo León
San Nicolás de los Garza, NL, México.