acidos
Son sustancias que, en una solución acuosa, liberan protones (H+). Se clasifican en dos grupos:
- Acidos oxigenados (oxácidos)
- Acidos no oxigenados (hidrácidos)
- Oxácidos
Se forman a partir de óxidos ácidos que reaccionan con agua:
óxido ácido + H2O 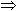 oxácido
oxácido Una molécula del óxido ácido reacciona con una molécula de agua. Con respecto a la nomenclatura, cuando tenemos los oxácidos de un elemento, el compuesto menos oxigenado termina en oso, y el compuesto más oxigenado termina en ico.
De acuerdo a la cantidad de moléculas de agua intervinientes se forman distintos compuestos oxácidos.
- Hidrácidos
Se obtienen por la disolución de halogenuros de hidrógeno y sulfuro de hidrógeno en agua.
El hidrógeno en una solución acuosa obtiene su carater de ácido, ionizándose; esto ocurre porque la unión covalente polar se transforma en iónica por acción del agua (solvente polar).
Con respecto a la nomenclatura, se utiliza el sufijo hídrico.
aniquilacion de pares
En la aniquilación de un par electrón-positrón, el electrón efectúa una transición al estado de energía negativa vacante que corresponde al positrón.
Las dos partículas se aniquilan, y en su lugar aparece una energía:
E= 2mc2 constituyendo una radiación electromagnética.
En el proceso de aniquilación de positrones libres en reposo por electrones libres, esta energía aparece como dos fotones de direcciones opuestas. Cada uno de estos fotones tendrá una energía de:
mc2 = 0.511 MeV Se llama a esta radiación de aniquilación.
aproximacion al concepto de temperatura
Cuando un cuerpo es enfriado o calentado sus propiedades se modifican. Un cuerpo para el que sólo se admiten variaciones térmicas, se conserva a una misma temperatura mientras sus propiedades no varían.
Al situar varios cuerpos en contacto, dentro de un ambiente limitado, sus temperaturas varían hasta llegar a un estado de
equilibrio térmico.
Si dos cuerpos están en equilibrio térmico con un tercero, están en equilibrio térmico entre sí. A este postulado se le suele llamar
Ley Cero de la Termodinámica.
En el termómetro de mercurio señalaremos las posiciones que ocupa el extremo de la columna cuando se lo pone en contacto con hielo fundente y agua hirviendo. La diferencia entre estos dos límites se divide en 100 partes iguales, obteniéndose la escala Celsius o centesimal.
La temperatura define la dirección en la que fluye el calor.
bases
Las bases o hidróxidos presentan en su estructura radical hidróxido a anión oxidrilo. Se trata de un ión negativo (anión) resultante de la unión covalente de un átomo de oxígeno con un átomo de hidrógeno. El oxígeno se queda con la carga adicional.
El radical se comporta como un ión monovalente.
Para formar un hidróxido metálico, por cada catión metálico se utilizan tantos aniones hidróxidos como cargas posea el catión, es decir, se utilizan tantos aniones hidróxidos como electrones de valencia presenta el metal.
calor latente
Sean:
i: estado inicial,
f: estado final,
S: entropía,
V: volumen,
no: número de moles al inicio,
T: temperatura.
Es:
S = no ( 1 - x) Si + x no Sf
V = no ( 1 - x ) Vi + no x Vf
Un cambio reversible implica que el calor latente (calor por mol) será:
l = T ( Sf - Si )
descripcion cinetica de un gas
Un gas está compuesto por moléculas libres e independientes de masa
m, las cuales se mueven aleatoriamente en todas direcciones, colisionan frecuentemente e intercambian energía en tales choques.
Dado un volumen V que contenga N moléculas, la
densidad numérica de las moléculas en un gas es:
n = N / V (1.1) Una molécula en particular sufre colisiones y cambios de dirección aleatorios, y viaja alguna distancia promedio l entre choques; esta cantidad se llama camino libre medio.
Además, las moléculas que vienen desde el seno del gas con un cierto rango de velocidades impactan sobre la pared del recipiente que lo contiene; el número total J de impactos moleculares por unidades de área de la pared de la cámara en un segundo se llama ritmo de impacto o flujo de partículas.
En este análisis, se supone que las moléculas se compartan como esferas elásticas duras, de tamaño despreciable frente a la distancia que las separa. Cabe entonces mencionar que, si bien los resultados que se obtienen son para un gas ideal, los gases reales a bajas presiones se aproximan mucho a este estado.
diamagnetismo
Las características diamagnéticas de un material se deben a la
precesión de Larmor del movimiento orbital de los electrones de sus átomos constituyentes, en presencia de un campo magnético externo.
- ¿Cuándo se observa el diamagnetismo?
Cuando se aplica un campo a un material tal que el momento magnético de sus átomos es nulo en ausencia de campo exterior.
Todo material tiene características diamagnéticas, las cuales en las sustancias para y ferromagnéticas son enmascaradas.
El cloruro de sodio y el cuarzo son materiales diamagnéticos.
espectroquimica
Utiliza los espectros de emisión de los metales para llevar a cabo análisis químicos.
Esta aplicación que constituyó uno de los primeros éxitos de la
espectroscopía, al demostrar la existencia de elementos químicos iguales que los terrestres primero en el Sol y, más tarde, en otros objetos celestes, y al descubrir elementos desconocidos apoyándose en su espectro (el gas noble helio, p.e.), se ha desarrollado muy considerablemente.
Hoy en día todas las grandes industrias metalúrgicas poseen espectrógrafos y espectrómetros especialmente diseñados para este tipo de estudios, algunos de ellos completamente automáticos como el cuantómetro y otros utilizando nuevas técnicas de producción del espectro, especialmente aptas para problemas industriales.
Espectroscopia de absorcion atomica
Merece mención especial la llamada espectroscopía de absorción atómica que, aprovechando la absorción selectiva de radiación por los átomos del metal que se quiere investigar, permite llevar a cabo análisis muy precisos de elementos químicos, aún en mezclas muy complejas.
Ferromagnetismo
Las propiedades ferromagnéticas de un material se deben a los momentos magnéticos asociados al
spín de los electrones no apareados, cuya interacción mutua es muy fuerte.
En la mayoría de los materiales, la energía de interacción se mantiene en un valor mínimo cuando en la red cristalina los átomos están distribuidos de tal forma que los spines de los electrones de átomos vecinos están orientados en oposición. Sin embargo, en los materiales ferromagnéticos, esta condición se cumple cuando los momentos magnéticos de los átomos aledaños son paralelos, lo cual explica por qué son tan fuertemente magnéticos.
El hierro es un material ferromagnético.
oxidos
Se trata de compuestos binarios oxigenados:
elemento + oxígeno ---> óxido Cuando un metal se une al O2 lo hace mediante enlaces iónicos, con lo que se tiene un óxido iónico. Si el elemento a unirse con el O2 es un no metal, se conforma un enlace covalente, por lo tanto:
metal + O2 ---> óxido iónico
no metal + O2 ---> óxido covalente Los óxidos iónicos se llaman también óxidos básicos debido a que, cuando reaccionan con agua, originan hidróxidos metálicos, que son las bases.
 Nomenclaturas de los compuestos que se forman:
Nomenclaturas de los compuestos que se forman:
Clásica: " óxido de ...".
Por atomicidad: se indica el número de átomos de cada tipo que forman el óxido.
paramagnetismo
Las características paramagnéticas de un material se deben a los momentos magnéticos asociados al
spín de los electrones de algunos de sus átomos constituyentes.
En la mayoría de los átomos, los momentos magnéticos asociados tanto al spín como al movimiento orbital de sus electrones se anulan entre sí, de manera que tales átomos no son magnéticos.
Pero en los átomos con un
número impar de electrones en los cuales el momento magnético debido al spín de por lo menos uno de sus electrones no tiene oposición, el electrón no apareado confiere a estos átomos un momento magnético, que reaccionará con un campo magnético exterior.
primer principio de la termodinamica
Si un sistema es obligado a pasar de un estado inicial a otro final mediante procesos adiabáticos, el trabajo es el mismo, para todas las trayectorias adiabáticas que unen ambos extremos.
Consecuencias:
- Si i es el estado inicial y f el estado final,
el trabajo W (en forma adiabática) estará representado por la diferencia de energía interna U entre los dos estados:
Uf - Ui = - Wif
Uf - Ui = DU por el incremento de la energía del
sistema por un aporte de trabajo Además, DU es una diferencial de funciones reales.
- Si el proceso no es adiabático,
DW ¹ DU porque, en este caso, hay transferencia de energía.
Si llamamos Q (calor), tenemos:
Uf - Ui = Q - W lo cual constituye una versión más completa del Primer Principio de la Termodinámica.
El calor Q es un flujo de energía entre dos cuerpos.
- Los aspectos destacables del Primer Principio son:
- Existe una función de energía interna.
- Existe un principio de conservación.
- Se define el calor como una cantidad de movimiento.
principio de exclusion de pauli
El concepto de spín del electrón condujo a un aplicación más completa de la
Tabla Periódica, apoyada por el Principio de Exclusión, formulado por Pauli en 1925:
En un sistema que contenga varios electrones, dos de éstos no pueden estar en el mismo estado, caracterizados por los mismos cuatro números cuánticos n, l, m y ms
Supongamos, haciendo una aproximación, que los átomos poseen un orden de estadios de energía similar a los del hidrógeno.
Se necesitan cuatro números cuánticos para describir el estado del electrón; éstos son, con sus respectivas restricciones:
- nº cuántico principal: n = 1, 2, 3, ...
- nº cuántico orbital: l = 0, 1, 2, ..., (n-1)
- nº cuántico magnético: m = 0, ±1, ±2, ..., ±l
- nº cuántico del spín: ms = ±½
Vamos a considerar a los átomos en sus estados fundamentales, con una carga nuclear Ze y un número atómico Z.
En el caso del H (Z=1), sólo hay un electrón y n=1 para su estado fundamental.
En el He (Z=2) se presentan dos electrones. Ambos pueden encontrarse en el estado de energía más bajo (n=1), ya que son posibles dos valores para el número cuántico m
s. Los números cuánticos para los dos electrones son:
1, 0, 0, + ½
1, 0, 0, - ½
De esta forma, observamos que no contradicen el principio de exclusión.
En el Li (Z=3), para el nivel de energía n=1, l y m deben ser 0, y m
s =
±½. Para este nivel:
1, 0, 0, + ½
1, 0, 0, - ½
En consecuencia, el tercer electrón debe ir al nivel de energía n=2.
De esta manera, puede irse completando la tabla periódica entera.
segundo principio de la termodinamica
- Enunciado de Kelvin - Plank
Es imposible construir un motor que, funcionando según un ciclo, no produzca otro efecto que extraer calor de un foco, y extraer una cantidad equivalente de trabajo.
- Enunciado de Clausius
Es imposible construir un dispositivo que funcione según un ciclo y no produzca otro efecto que el paso de un cuerpo a otro más caliente.
superficies pvt para sustancias reales
P: presión
V: volumen específico
T: temperatura
La
ecuación de estado de una sustancia define una relación entre la presión, el volumen específico y la temperatura.
Todos los estados de equilibrio posibles de una sustancia se encuentran sobre la superficie PVT.
Las sustancias reales se presentan en fase gaseosa sólo a temperaturas altas, y a presiones bajas. A temperaturas bajas y presiones elevadas, ocurren transiciones a la fase líquida y a la fase sólida.
Existen regiones en las que la sustancia se encuentra en una sola fase y en otras regiones de la superficie PVT (sólido y líquido, sólido y vapor, líquido y vapor) ambas fases pueden coexistir.
Simultáneamente, en equilibrio, coexisten las tres fases a lo largo de una línea denominada línea triple.
Una curva dada en la superficie representa una sucesión de estados de equilibrio.
Recordemos que muchas situaciones observadas en los modelados no ocurren de la misma manera en la naturaleza, sino que se hace una aproximación para su mejor estudio.
tabla periodica de elementos
La Tabla Periódica está conformada por el ordenamiento de los elementos químicos de acuerdo con la estructura electrónica de sus átomos. Para configurarla, en 1870, Mendeleiev (ruso, 1834-1907) descubrió periodicidades en las propiedades de los elementos, postulando una Ley Periódica, que expresaba lo siguiente:
"Las propiedades de los elementos son funciones periódicas de sus masas atómicas".
En el primer ordenamiento que se efectuó siguiendo la ley anterior, quedaron espacios incompletos, que correspondían a elementos aún no descubiertos, pero sus propiedades y masas atómicas pudieron ser predichos.
Posteriormente, en 1913, Moseley (británico, 1887-1915) reformuló la Ley Periódica del modo que sigue:
"Las propiedades de los elementos son funciones periódicas de sus números atómicos".
Tomemos el siguiente ordenamiento:
| 1A | 2A | 3B | 4B | 5B | 6B | 7B | 8B | 1B | 2B | 3A | 4A | 5A | 6A | 7A | 8A |
| | | | | | | | | | | | | | | H | He |
| Li | Be | | | | | | | | | B | C | N | O | F | Ne |
| Na | Mg | | | | | | | | | Al | Si | P | S | Cl | Ar |
| K | Ca | Sc | Ti | V | Cr | Mn | Fe-Co-Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru-Rh-Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os-Ir-Pt | Au | Hg | Tl | Pb | Bi | Po | At | Ra |
| Fr | Ac | Ra | | | | | | | | | | | | | |
Llamamos
período a cada una de las filas horizontales, con lo que tenemos 7 períodos en total.
Los 8 grupos, divididos en 2 subgrupos A y B están representados por las columnas verticales.
En el caso del subgrupo A, excepto en el He, el número de grupo coincide con la cantidad de electrones que tienen los átomos en el último nivel de energía. Se llama
representativos a los elementos del subgrupo A.
Los subgrupos B constituyen los
elementos de transición, y tienen incompletos los dos últimos niveles de energía.
Existen otros elementos, los de
transición interna (lantanoides y actinoides), que tienen incompletos los últimos 3 niveles.
* En 1999 se anunció el descubrimiento de dos elementos que no figuraban en la Tabla Periódica. Habían sido descubiertos al chocar partículas de criptón contra una superficie de plomo. Pero parece que uno de los elementos (el 118) no tenía una "vida" lo suficientemente larga como para formar parte de la Tabla por lo que todavía se efectúan tratativas para incluirlo (o no).
tercer principio de la termodinamica
Es imposible, por idealizado que sea el proceso, reducir un sistema a 0º K de temperatura en un número finito de operaciones.
- Enunciado de Nernst-Simon: la variación de entropía ligada a cualquier proceso isotermo reversible tiende a cero al mismo tiempo que la temperatura.
- Enunciado equivalente: por idealizado que sea el proceso a seguir, es imposible reducir la entropía de un sistema a su valor en el punto cero mediante un número finito de operaciones.
termometria
Tomemos un sistema patrón de coordenadas
x,
y, al que llamaremos termómetro, y cualquier trayectoria en el plano
xy, por ejemplo:
y1

Establecer una escala de temperatura es asignar valores numéricos a las isotermas de este sistema patrón.
Cada uno de los puntos en que y1 corta a las isotermas posee:
= y
¹ x La temperatura asociada a cada isoterma debe tomarse como una función de la coordenada x en ese punto. Esta x se denomina magnitud termométrica y, según el termómetro, es:
| TERMOMETRO | MAGNITUD TERMOMETRICA |
| Gas a volumen constante | presión |
| Gas a presión constante | volumen |
| Columna de líquido en un capilar vítreo | longitud |
Con y constante y a constante arbitraria, tenemos la siguiente función:
q (x) = ax con lo que la razón de dos temperaturas, x1 y x2, en escala lineal es:
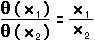
transformacion de trabajo en calor y calor en trabajo
En general, puede efectuarse un trabajo W sobre un sistema que está en contacto con un foco calorífico. Esto da origen a un flujo de calor Q que no altera el estado del sistema.
Para estudiarse el proceso inverso se requiere un ciclo.
Si Q
1> 0, es el calor absorbido por el sistema, Q
2> 0, el calor que el sistema ha cedido, y W = Q
1 - Q
2 es el trabajo realizado por el sistema, si Q
1> Q
2, el dispositivo mediante el cual el sistema recorre el ciclo es un motor térmico. Es importante destacar que los procesos cíclicos difieren de los naturales, constituyendo una aproximación que facilita el estudio.
El trabajo neto de un ciclo es la energía suministrada al exterior, y el calor adquirido es la energía absorbida.
El rendimiento térmico o eficiencia de este motor, tomando W y Q en unidades de energía, se define como:
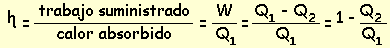
De aquí observamos que el rendimiento será del 100% (lo cual no es verificable experimentalmente) cuando h = 1, es decir, cuando Q2 = 0. Se trataría de una transformación íntegra de trabajo en calor.
union quimica interatomica: union covalente
La unión covalente se observa entre átomos de no metales (ya sea del mismo o de no metales diferentes).
En la unión
covalente común, dos átomos no metálicos comparten uno o varios pares de electrones, y los electrones que constituyen cada par provienen uno de cada átomo.
En la unión
covalente dativa intervienen como electrones de valencia los electrones apareados (habiéndose utilizado ya los electrones no apareados).
union quimica interatomica: union ionica
La unión iónica se observa en los compuestos conformados por átomos metálicos y no metálicos. El enlace iónico está dado por la fuerza electrostática que mantiene ambos iones (positivo y negativo) juntos. Es decir, se trata de un enlace electrostático.
Se observa OXIDACION cuando un átomo pierde electrones
Se observa REDUCCION cuando un átomo gana electrones
union quimica interatomica: union metalica
Los electrones más externos de un metal no se transfieren ni se comparten con otros átomos, sino que circulan entre ellos. Se los llama
electrones libres y conforman la unión interatómica metálica. Es decir, un metal está conformado por iones positivos rodeados por una nube de electrones que llenan los orbitales libres al moverse.
union quimica intermolecular: interaccion dipolo - dipolo
En un enlace
covalente polar, la molécula puede tener dos áreas separadas, negativa y positiva, constituyendo así un
dipolo.
De esta manera, las moléculas tienden a ubicarse tal que el polo negativo de una molécula se acerca al negativo de otra. Esta es la
interacción dipolo - dipolo. El grado de interacción en este tipo de enlace es determinante de los puntos de ebullicón y fusión de las sustancias que lo presentan.
- ¿De qué depende la atracción entre estas moléculas?
- del tamaño de las mismas,
- de la distancia entre ellas.
union quimica intermolecular: interaccion por fuerzas de london
A diferencia de la interacción dipolo - dipolo, esta interacción se presenta en moléculas no polares. Los electrones de estas moléculas están en movimiento de manera continua, lo que puede producir desequilibrios en la distribución de carga molecular. Este fenómeno origina
dipolos transitorios que inducen la polarización de las moléculas vecinas.
union quimica intermolecular: puente hidrogeno
Se observa en moléculas que tienen por lo menos un átomo de hidrógeno ( H ) unido en forma covalente a otro átomo, debiendo ser este último, altamente electronegativo, y con al menos un par electrónico no compartido.
Este tipo de unión molecular aparece en compuestos hidrogenados de los
no metales del segundo período, como el oxígeno y el flúor.

