 Indicateurs colorés Acide -
Base
Indicateurs colorés Acide -
BaseLes indicateurs Acide - Base (aussi connus comme indicateurs
de pH ) sont des substances qui changent de couleur avec le pH.
Ce sont généralement des acides ou des bases faibles,
qui dans l'eau se dissocient faiblement et forment des
ions.
Considérons un indicateur qui est un acide faible, de
formule HIn. A l'équilibre, l'équilibre suivant est
établi avec la base conjuguée:
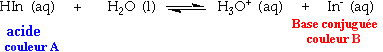
L'acide et sa base conjuguée ont des couleurs
différentes. A un pH bas, la concentration en
H3O+ est grande et ainsi l'équilibre
évolue vers la gauche et la solution a la couleur A. A pH
élevé, la concentration en H3O+
est faible , la position d'équilibre évolue vers la
droite et la solution prend la couleur B.
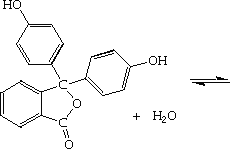
La phénolphthaléine est un exemple d'indicateur
coloré qui, en solution aqueuse, établit ce type
d'équilibre:
 |
 |
| Incolore (Acide) | Rose (Base) |
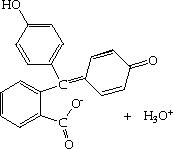
La phénolphthaléine est incolore , c'est un acide
faible qui se dissocie dans l'eau pour former des anions de
couleur rose. En milieu acide, l'équilibre est
déplacé vers la gauche, et la concentration en anions
est trop faible pour donner une coloration rose . Toutefois, en
milieu basique, l'équilibre est déplacé vers la
droite, et la concentration en anions commence à être
suffisante pour observer la coloration rose .
On peut appliquer les lois des équilibres chimique à
l'équilibre d'un indicateur coloré. En
général l'indicateur est un acide faible:
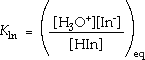
Kln est connue comme la constante de dissociation de l'indicateur . La
couleur de l'indicateur change de la couleur A à la couleur
B ou vice versa au point de virage. En ce point:
On aura ainsi :
Le pH de la solution au point de virage est appelé le
pKln. On trouve aussi l'expression
pKA quand on représente l'indicateur par
HA.
| Indicateur | Couleur | pKln | Zone de virage | |
| Acide | Base | |||
| Acide picrique | incolore | jaune | 0.38 | 0.2 - 1.0 |
| Rouge de crésol - 1er virage | rouge | jaune | ? | 0.4 - 1.8 |
| Bleu de thymol - 1er virage | rouge | jaune | 1.5 | 1.2 - 2.8 |
| Hélianthine ou méthylorange | rouge | jaune | 3.7 | 3.2 - 4.4 |
| Rouge Congo | bleu | rouge | 4.0 | 3.0 - 5.2 |
| Vert de bromocrésol | jaune | bleu | 4.7 | 3.8 - 5.4 |
| Rouge de méthyle | jaune | rouge | 5.1 | 4.8 - 6.0 |
| p-Nitrophénol | incolore | jaune | 7.15 | 5.6 - 7.6 |
| Bleu de bromothymol | jaune | bleu | 7.0 | 6.0 - 7.6 |
| Rouge de phénol | jaune | rouge | 7.9 | 6.8 - 8.4 |
| Rouge de crésol - 2nd virage | jaune | rouge | 7.9 | 7.0 - 8.8 |
| Bleu de thymol - 2nd virage | jaune | bleu | 8.9 | 8.0 - 9.6 |
| Phénolphthaléine | incolore | rose | 9.4 | 8.2 - 10.0 |
| Thymolphtaléine | rouge | jaune | 10.0 | 9.4 - 10.6 |
| Jaune d'alizarine | jaune | rouge | 11.0 | 10.0 - 12.0 |
| 2-4-6-Trinitrotoluène | incolore | orange | ? | 11.5 - 13.0 |
| 1,3,5-Trinitrobenzène | incolore | orange | ? | 12.0 - 14.0 |
Vous pouvez voir les zones de virage de différents
indicateurs colorés en cliquant sur
autres indicateurs
Un Indicateur Universel est un mélange
d'indicateurs, il donne un changement graduel de couleur selon la
valeur du pH. Le pH d'une solution peut être
approximativement évalué quand on a versé quelques
gouttes de cet indicateur dans la solution .
Les indicateurs colorés sont utilisés dans le dosage des solutions pour signaler l'équivalence dans une réaction acido-basique.
Cliquer pour l'applet "Courbe de titrage".