 États de la
matière
États de la
matièreLa matière est tout ce qui a une masse et qui occupe un
volume. C'est de quoi est fait l'univers.
La matière peut se retrouver dans plusieurs états ou
phases. Les trois états les plus connus sont solide, liquide
et gazeux.
Note:
Il existe aussi d'autres états un peu plus exotiques, tel
que plasma, cristal liquide, condensat de Bose-Einstein et
superfluide.
Plasma: c'est, en physique, un
milieu constitué de particules neutres, d'ions et
d'électrons.
La transformation d'un gaz vers un plasma (gaz ionisé) ne
s'effectue pas à température constante pour une
pression donnée, avec une chaleur latente de changement
d'état, comme pour les autres états, mais il s'agit
d'une transformation progressive. Lorsqu'on chauffe un gaz
suffisamment, les électrons des couches extérieures
peuvent être arrachés lors des collisions entre
particules, ce qui forme le plasma. Alors que le plasma est
globalement neutre, la présence de particules
chargées donne naissance à des comportements
inexistants dans les fluides, en présence d'un champ
électromagnétique, par exemple.
Un plasma peut également se former à basse
température si la source d'ionisation lui est
extérieure. C'est le cas de l'ionosphère, cette
couche élevée de l'atmosphère terrestre qui,
bien que froide, subit en permanence un intense bombardement
ionisant de particules venant du soleil. Les aurores polaires
sont l'une des manifestations de ce plasma.
Cet état est le plus représenté dans l'univers,
dans les étoiles, le milieu interstellaire et aussi
l'ionosphère terrestre (99%).
À une autre échelle, on trouve également des
plasmas dans les tubes fluorescents (improprement appelés
néons), les propulseurs spatiaux et ils sont couramment
utilisés dans l'industrie notamment en
micro-électronique.
Cristal liquide: deux termes
plutôt contradictoires, non ?
Les liquides coulent, les solides non. Les molécules dans
les solides peuvent être rangées, mais les
molécules dans les liquides ne le sont pas. Ou le
sont-elles ? Il est parfois possible pour un matériau de
s'écouler comme un liquide même si ses molécules
sont bien ordonnées. Pense à un paquets de troncs
descendant une rivière en flottant. Ils s'écoulent
très bien, mais ils restent toujpours ordonnés,
pointant vers la même direction.
C'est ainsi que se comportent les molécules dans les
cristaux liquides. Comme les liquides, elles s'.coulent et
peuvent être versées. Mais leurs molécules
tendent à s'aligner comme les troncs descendant la
rivière. Dans ce type de matériau, les molécules
sont longues, minces et rigides ... comme des troncs. C'est ce
qui arrive dans certains polymères.
Condensat de Bose-Einstein: la
condensation de Bose-Einstein est l'apparition d'un état
particulier d'un gaz quantique à très basse
température.
Les condensats de Bose-Einstein ont montré des
caractéristiques surprenantes. Comme ses atomes se
déplacent et réagissent collectivement, un condensat
se comporte comme un fluide parfait, qui s'écoule sans
viscosité ni perte d'énergie.
La première observation de la condensation de
Bose-Einstein d'un gaz atomique a eu lieu en 1995, suite au
travail d'Eric Cornell et Carl Wieman (University of Colorado)
qui refroidirent un gaz de rubidium à des
températures inférieures à 170 nanokelvins,
c'est-à-dire à 0,000 000 02 degrés au-dessus du
point zéro absolu. Cette expérience leur valut de
partager le Prix Nobel de physique 2001 avec Wolfgang
Ketterle.
Superfluide: La superfluidité
est un état quantique de la matière qui a
été découvert pour la première fois en 1937
par Pyotr Leonidovitch Kapitsa, simultanément avec,
semble-t-il, John F. Allen et A. Don Misener. Les physiciens
mentionnés ci-dessus ont constaté qu'en dessous de la
température critique de 2,17 Kelvin, (soit
-270,98°C), ce que nous appelons le point lambda (λ),
l'hélium 4 subissait une transition de phase. Il passait
d'un état liquide à un autre aux propriétés
sensiblement différentes. En effet, l'expérience,
confirmée par la suite, montra que ce nouvel état de
l'hélium conduisait très bien la chaleur, ce qui ne
pouvait s'expliquer que par une faible viscosité. En bref,
un liquide est dit superfluide s'il n'oppose aucune
résistance à l'écoulement, en conséquence,
les solides qui se meuvent dedans ne subissent aucun frottement
visqueux. Le superfluide est toutefois différent d'un
condensat de Bose-Einstein du fait des fortes interactions
entre ses constituants.
 |
 |
 |
| Vue microscopique d'un gaz | Vue microscopique d'un liquide | Vue microscopique d'un solide |
Remarque:
Le tableau suivant résume les propriétés des gaz, des liquides et des solides:
| Principales caractéristiques des gaz, liquides et solides | ||
| Gaz | Liquide | Solide |
| prend la forme et le volume de son
contant les particules peuvent se séparer les unes des autres |
a un volume déterminé, mais
prend la forme de son contenant les particules peuvent glisser les unes sur les autres |
a un volume déterminé et une
forme propre rigide - les particules sont maintenues en place |
| très compressible beaucoup d'espace libre entre les particules |
peu compressible peu d'espace libre entre les particules |
difficilement compressible peu d'espace libre entre les particule |
| coule facilement les particules peuvent se séparer les unes des autres |
coule facilement les particules peuvent glisser les unes sur les autres |
ne coule pas facilement rigide - les particules ne peuvent pas glisser les unes sur les autres |
Lorsque la matière passe d'un état à l'autre,
elle effectue une transition de phase. Ce phénomène est
étudié en thermodynamique via les diagrammes de phase.
La transition de phase se produit lorsque certaines
caractéristiques de la matière changent : pression,
température, volume, densité, énergie, etc.
Quand il reçoit ou perd suffisamment de chaleur, un corps
peut passer d'un état à un autre selon le schéma
ci-dessous:
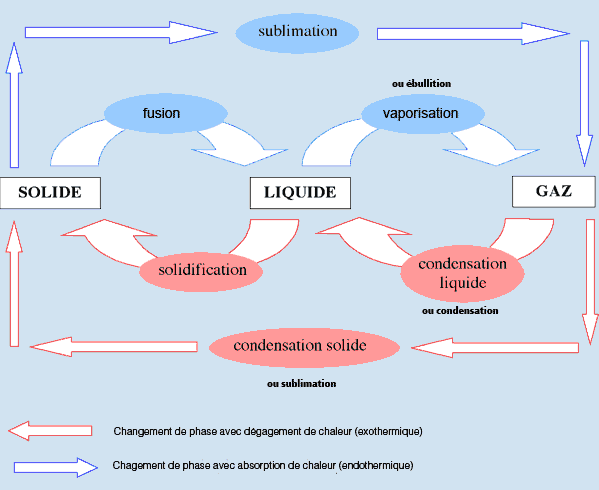
Remarques: