
Oxydation et anode
commencent toutes deux par des voyelles.
Réduction et cathode
commencent toutes deux par des consonnes.
Il en va de même pour les appareils électrolytiques et pour les cellules électrochimiques.
Le mouvement de particules chargées.
Les métaux sont généralement d'excellents conducteurs de l'électricité parce que leurs électrons se déplacent facilement. Si l'énergie potentielle des électrons du métal s'accroît, ces électrons vont aller vers un endroit où leur énergie potentielle est plus basse. Ce mouvement d'électrons dans les métaux s'appelle conduction métallique.
Les substances qui produisent des ions en solution sont des électrolytes. Les ions de charge positive sont appelés cations et les ions de charge négative sont appelés anions. Les ions en solution se déplacent d'une zone de haute énergie vers une zone d'énergie plus faible, produisant ainsi un courant. Ce mouvement des ions en solution s'appelle conduction électrolytique.
Si les électrodes d'une pile sont placées dans une solution ionique, un courant se produira entre les électrodes de la même façon que le mouvement des électrons dans un métal produit un courant. Cela produit une réaction rédox à chaque électrode par un processus connu sous le nom d'électrolyse.
Le montage électrolytique utilisé pour l'électrolyse comporte trois parties essentielles:
| Une source de courant continu pour procurer l'énergie nécessaire à la réaction. |
| Deux électrodes, la cathode et l'anode. La cathode procure la surface de contact entre les électrons de la source d'énergie et le réactif de la solution qui sera réduit. La cathode a une charge négative et attire les cations de l'électrolyte. L'anode procure la surface de contact où le réactif oxydé peut déposer les électrons qu'il perd. L'anode a une charge positive et attire les anions de l'électrolyte. |
| Un électrolyte. C'est la substance dans une phase dissoute ou liquide qui permet aux ions de se déplacer entre les électrodes, ce qui équilibre le flux des électrons dans le circuit externe. |
 |
Pour se rappeler quelle demi-réaction rédox se
passe à quelle électrode:
Oxydation et anode
commencent toutes deux par des voyelles. Il en va de même pour les appareils électrolytiques et pour les cellules électrochimiques. |
 |
La charge de l'électrode n'est pas la même dans
les appareils électrolytiques et dans les cellules
électrochimiques:
|
Certains termes utilisés en électricité:
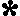 Différence de potentiel
électrique: la tendance relative de deux substances
de prendre des électrons.
Différence de potentiel
électrique: la tendance relative de deux substances
de prendre des électrons.
Lors de l'électrolyse, une réaction rédox n'a lieu que quand de l'énergie est procurée par une source extérieure. Une réaction rédox se passe spontanément dans les cellules électrochimiques à cause de la différence de potentiel électrique entre les deux électrodes.
 |
Pour qu'une substance prenne des électrons, il faut
qu'une autre substance en donne. C'est ce qui constitue les
deux moitiés d'une cellule électrochimique. Une
comparaison de l'attraction des électrons de ces
demi-cellules donne les potentiels d'électrode.
La somme des deux potentiels
d'électrode donne le potentiel (voltage) de la
cellule. Comme les potentiels de réduction standards sont des potentiels de réduction, celui qui est le plus négatif doit voir son signe inversé pour obtenir son potentiel d'oxydation. |
 |
|
| e-introduits. ions Cu2+en solution gagnent des e- et sont réduits en Cu métal |
e- extraits. Zn métal perd des e-, est oxydé et donne des ions Zn2+ dans la solution |
Note: le pont
salin est constitué d'un tube en U rempli d'une
solution conductrice concentrée. Son rôle est de
permettre le passage du courant dans la cellule en
complétant le circuit électrique et d'assurer la
neutralité électrique des solutions. Dans le pont
salin, les cations (ions +) vont de l'anode à la cathode
pour neutraliser les ions négatifs en surnombre à cause
de la diminution d'ions Cu2+ tandis que les anions
(ions -) vont de la cathode à l'anode pour neutraliser
l'excès d'ions Zn2+ produits.
On bouche souvent les extrémités du tube par des
bouchons poreux (ouate, par ex.). De plus, son rôle peut
être tenu par une paroi poreuse entre les deux
demi-piles.
Cette cellule fonctionne parce que les électrons de valence du zinc ont une plus grande émergie que les électrons de valence du cuivre. Cela fait que le zinc a une plus grande tendance à donner des électrons que le cuivre. Dans le circuit extérieur, les électrons vont toujours se déplacer de l'anode négative vers la cathode positive.
Le zinc est l'anode:
- Un morceau de Zn métallique est immergé dans du ZnSO4 (aq)
- Les atomes du zinc métallique perdent des électrons et deviennent des ions de zinc en solution. La masse de l'électrode de Zn diminue.
- La demi-réaction est représentée par: Zn
Zn+2 + 2e-
C'est une demi-réaction d'oxydation.
L'oxydation se produit toujours à l'anode.- Façon rapide de représenter la réaction dans la demi-cellule:Zn|Zn+2
Le cuivre est la cathode:
- Un morceau de cuivre métallique est immergé dans CuSO4 (aq)
- Les ions cuivre en solution gagnent des électrons pour ajouter des atomes de cuivre au cuivre métallique. La masse de l'électrode de cuivre augmente.
- La demi-réaction est représentée par: Cu+2 + 2e-
Cu
C'est une demi-réaction de réduction.
La réduction a toujours lieu à la cathode.- Façon rapide de représenter la réaction dans la demi-cellule: Cu+2|Cu
Cette cellule fonctionne parce que:
- le cuivre métallique prend des électrons du zinc métallique.
- ces électrons se déplacent de l'anode à la cathode par le circuit extérieur.
- dès qu'il est produit, le Zn+2 va dans la solution.
- les ions SO4-2 de la solution se déplacent de la cathode vers l'anode au moyen du pont salin.
- la cellule continue à fonctionner tant qu'il y a une différence d'énergie potentielle entre les demi-cellules.
 |
Façon rapide de représenter la réaction dans
la cellule zinc-cuivre:
Zn|Zn+2||Cu+2|Cu
|
Cette table de potentiels de
réduction standards a été
utilisée pour trouver les potentiels des demi-cellules et
pour calculer le voltage de la cellule zinc-cuivre ci-dessus.
a été
utilisée pour trouver les potentiels des demi-cellules et
pour calculer le voltage de la cellule zinc-cuivre ci-dessus.
| Les calculs ressemblent à ceci: | Zn  Zn+2 + 2e- ......... +0,76 Volt
Zn+2 + 2e- ......... +0,76 VoltCu+2 + 2e-  Cu ........ +0,34 Volt Cu ........ +0,34 VoltTotal = +1,10 Volt  |
Ton niveau de compréhension de ce chapitre sera
déterminant pour comprendre le concept de
l'électrochimie. Étudie-le jusqu'à ce que tu
le maîtrises et sois préparé à
répondre, par exemple, aux questions suivantes:
|
 La
table des potentiels de réduction
standards: La
table des potentiels de réduction
standards:indique le voltage des demi-réactions de réduction.
|
 |
Règle de base:
Quand on compare les réactions de deux demi-cellules, la plus faible sera à la cathode. |
| Table
des potentiels de réduction standards (à 25oC, 101kPa, 1M) |
|||
 |
Demi-réaction | volts |  |
Li+ + e-  Li Li |
- 3,04 | ||
Al+3 + 3e-  Al Al |
- 1,68 | ||
Zn+2 + 2e-  Zn Zn |
- 0,76 | ||
Fe+2 + 2e-  Fe Fe |
- 0,44 | ||
2H2O + 2e-  H2 + 2OH - H2 + 2OH - |
- 0,41 | ||
Ni+2 + 2e-  Ni Ni |
- 0,26 | ||
Pb+2 + 2e-  Pb Pb |
- 0,13 | ||
2H+ + 2e-  H H |
0,00 | ||
Cu+2 + 2e-  Cu Cu |
0,34 | ||
Cu+ + e-  Cu Cu |
0,52 | ||
Fe+3 + e-  Fe+2 Fe+2 |
0,77 | ||
Ag+ + e-  Ag Ag |
0,80 | ||
O2 + 4H+2 + 4e-
 2H2O 2H2O |
0,82 | ||
Br2 + 2e-  2Br - 2Br - |
1,07 | ||
Cl2 + 2e-  2Cl - 2Cl - |
1,36 | ||
Au+3 + 3e-  Au Au |
1,52 | ||
 La table des
potentiels de réduction standards peut être
utilisée pour: La table des
potentiels de réduction standards peut être
utilisée pour: |
1.  prédire le sens des réactions
chimiques;
prédire le sens des réactions
chimiques;
 Ni+2 (aq) + Al
(cr)
Ni+2 (aq) + Al
(cr)Al+3  Al .
. . . . -1,68V (réduction, comme dans la
table) Al .
. . . . -1,68V (réduction, comme dans la
table)Ni  Ni+2 . . .
. . +0,26V (oxydation, à l'inverse de la
table) Ni+2 . . .
. . +0,26V (oxydation, à l'inverse de la
table)Le total est de -1,42V  |
2.  déterminer le voltage maximum produit par une
cellule électrochimique:
déterminer le voltage maximum produit par une
cellule électrochimique:
Zn  Zn+2 +
2e- . . . . . . 0,77V (oxydation, à
l'inverse de la table) Zn+2 +
2e- . . . . . . 0,77V (oxydation, à
l'inverse de la table)Fe+2 + 2e-  Fe . . . . . . -0,44V
(réduction, comme dans la table) Fe . . . . . . -0,44V
(réduction, comme dans la table)Le total est de 0,33V  |
 prédire les produits d'une
électrolyse:
prédire les produits d'une
électrolyse:
- Pour qu'un courant électrique passe dans une solution aqueuse de sel, une réaction chimique doit avoir lieu aux deux électrodes.
- À chaque électrode, l'eau sera en compétition avec le sel. Cela signifie qu'il y a toujours deux possibilités pour le produit à chaque électrode.
- Compare le voltage des deux possibilités à chaque électrode. Le voltage le moins négatif identifiera le produit.
|
| Exercices: Utilise la table des potentiels de réduction standards pour résoudre ces problèmes.  |
Certaines applications pratiques des cellules électrochimiques: VOIR ÉVOLUTION DES PILES
Pile sèche (acide):
| C'est la source d'énergie d'une lampe de poche ordinaire. La plupart des piles de lampe de poche fournissent 1,5 volt. Le revêtement de la cellule est du zinc métallique agissant comme anode. Au centre de la cellule se trouve un bâton de graphite jouant le rôle de cathode. Le bâton de graphite est entouré d'une pâte de MnO2 and NH4Cl. | 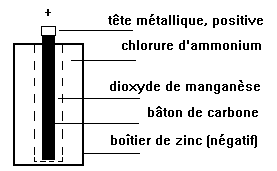 |
 Zn+2 + 2e
-
Zn+2 + 2e
- Mn2O3 (s) + 2NH3 (aq) +
H2O (l)
Mn2O3 (s) + 2NH3 (aq) +
H2O (l) PbSO4 (s) + 2e -
PbSO4 (s) + 2e - PbSO4 (s) + 2H2O (l)
PbSO4 (s) + 2H2O (l) Cd(OH)2 (s) + 2e -
Cd(OH)2 (s) + 2e - Ni(OH)2 (s) + 2OH-
(aq)
Ni(OH)2 (s) + 2OH-
(aq)
Lois de Faraday:
|
 Le Coulomb:
c'est la quantité d'électricité produite par un
courant d'un ampère circulant pendant une seconde.
Le Coulomb:
c'est la quantité d'électricité produite par un
courant d'un ampère circulant pendant une seconde.
- Coulombs = (ampères) x (secondes)
- 96 485 coulombs = 1 mole d'e-
|
Combien de grammes d'aluminium seront produits si 31500 coulombs d'électricité passent dans une solution de nitrate d'aluminium?
|
Exercices:
|