VALUTAZIONE DEI RISCHI DOVUTI AI PRODOTTI DI ATTIVAZIONE IN APPLICAZIONI TERAPEUTICHE ED ELABORAZIONE DI LINEE GUIDA
Introduzione
Il crescente impiego nei trattamenti radioterapici di fasci di radiazioni (x di frenamento ed elettroni) prodotti da acceleratori lineari sta attualmente soppiantando l’uso delle unità di cobaltoterapia emittenti fasci di fotoni g di energia media uguale a 1,2 MeV.
Poiché l’energia della radiazione prodotta da tali acceleratori risulta anche decine di volte superiore a quella prodotta dalle unità a cobalto, sorge il problema della valutazione della radioattività indotta nei materiali normalmente presenti all’interno di un bunker radioterapico. Infatti, tali materiali, investiti da fasci di fotoni o di elettroni, possono divenire radioattivi allorquando l’energia della radiazione incidente supera l’energia di legame di un nucleone (reazione fotonucleare) (O’Brien, 1985; Powell et al., 1987).
A seguito di ciascun irraggiamento, l’operatore sanitario che accede all’interno della sala di trattamento radioterapico durante le fasi di centratura del paziente e di posizionamento degli accessori per la modifica dei fasci, sarà esposto alle emissioni di radiazioni g (che determineranno un’esposizione del corpo intero), e di radiazioni b, (che comporteranno prevalentemente l’esposizione delle mani e della cute), causate dalla radioattività indotta nei materiali normalmente impiegati in un bunker di radioterapia (NCRP, 1984; Allen e Chaudhri, 1982).
In particolare la radioattività indotta dall’uso clinico degli acceleratori può contribuire all’esposizione del personale che accede alle sale di trattamento radioterapico quando vengono utilizzati fasci di raggi x con potenziale di accelerazione superiore a 10 MV (Epp et al., 1984). Per tali fasci la dose equivalente annua assorbita dall’operatore risulta essere compresa tra 500 e 2000 mSv/anno a seconda dell’energia dell’acceleratore e dei carichi di lavoro del centro radioterapico (Huda et al., 1989). Confrontando tali valori di dose con le dosi ambientali rilevate all’esterno della sala di trattamento, si è appurato che circa un terzo delle esposizioni del personale potevano essere dovute alla radioattività indotta (Hoffman e Nath, 1982).
Dosimetria del personale operante presso la Divisione di Radioterapia dell’UCSC (Università Cattolica del Sacro Cuore) effettuata mediante dosimetri TLD, ha evidenziato dosi variabili intorno ai 2000 mSv/anno.
Al fine di valutare direttamente il rischio di esposizione di tali operatori , sono stati presi in esame i contributi di dose derivanti dalla radioattività indotta (Ahlgren e Olsson,1988; Maspero, 1994):
· nell’aria presente nella sala di trattamento;
· negli accessori per la modifica del fascio normalmente presenti nei trattamenti radioterapici (schermature sagomate personalizzate e filtri a cuneo);
· nei componenti dell’acceleratore.
In questa relazione sono riportati i risultati riguardanti misure sia di ratei di dose che di spettrometria gamma della radioattività indotta nei materiali normalmente impiegati nella pratica clinica all’interno di un bunker radioterapico.
In particolare, i risultati dosimetrici qui riportati si riferiscono a misure eseguite presso una delle sale di trattamento radioterapico della Divisione di Radioterapia dell’UCSC, in cui operante un acceleratore lineare Saturne 43. Tale acceleratore fornisce raggi x da 6, 10 e 18 MV e fasci di elettroni fino a 21 MeV .
In base a quanto riportato in letteratura (Allen e Chaudhri, 1982), le procedure dosimetriche adottate, sono quelle più idonee per una accurata stima dell’esposizione degli operatori a causa della radioattività indotta.
La strumentazione utilizzata per le suddette
misure è consistita in:
·
una catena
spettrometrica al Ge-Li mod. ORTEG GMW 25190–P per l’individuazione di
radioisotopi gamma emettitori,
·
un contatore
proporzionale mod. RADOS Microcont
versione H13422 con sonda HXE a finestra sottile in titanio per misure di ratei
di conteggio su fasci di radiazioni b e g,
·
una camera a
ionizzazione SmartION mod. 2120 tarata per misure di ratei di dose equivalente
su fasci di radiazione g di energia compresa tra
18 keV e 1,3 MeV e su fasci di radiazione b
di energia compresa tra 0,2 e 2,5 MeV.
Ulteriore strumentazione è
stata utilizzata per misure da considerarsi di corollario alla presente
ricerca:
·
un lettore automatico di T.L.D.
mod. HARSHAW/BICRON 5500 per la lettura di dosimetri a termoluminescenza utilizzati
per la sorveglianza fisica del personale professionalmente esposto,
·
un densitometro
Victoreen mod. 07 – 444 e pellicole radiografiche Kodak X-OMAT XL,
·
un campionatore
d’aria mod. CF – 993B HI-Q,
·
un rivelatore a
scintillazione mod. 44-20 LM
·
un intensimetro
Ludlum mod. ML 2350-1.
La stima delle dosi assorbite dal personale addetto all’esecuzione dei trattamenti radioterapici è stata effettuata ipotizzando condizioni cautelative che comportavano l’impiego di fasci di raggi x da 18 MV per l’intero carico di lavoro dell’operatore. Ciò ha permesso di confrontare i valori di dose attesi nelle normali condizioni di lavoro ed i valori massimi, ipotizzabili in condizioni estreme, con quelli presenti in letteratura.
La radioattività indotta
nell’aria della sala di trattamento
In generale, i fasci di radiazione x ed i fasci di elettroni prodotti da un acceleratore lineare di alta energia, impiegato a scopo radioterapeutico, possono produrre attivazione dell’aria di un bunker di radioterapia. La quantità di radioattività indotta dipende dal rateo di emissione delle radiazioni, dalla loro energia e dalla durata dell’irraggiamento (Lucci et al. , 1974).
E’ utile
ricordare, a tale proposito, che un nucleo, a seguito dell’assorbimento di un
fotone di alta energia, può trovarsi in uno stato eccitato e quindi tornare in
uno stato stabile emettendo uno o più nucleoni (protoni o neutroni). La sola
condizione perché ciò avvenga è che l’energia dei fotoni incidenti, Eg , sia superiore all’energia di separazione di un nucleone in un nucleo.
Quest’ultima rappresenta dunque l’energia di soglia per reazioni fotonucleari
di tipo (g,n)
o (g,p).
Bisogna però sottolineare che le reazioni fotonucleari che intervengono nella
produzione della radioattività indotta,
dovute a fasci di radiazioni di energia inferiore a 35 MeV, sono rappresentate
essenzialmente da processi con fotoproduzione di un solo neutrone (g,1n); infatti per tali
reazioni si hanno i massimi valori delle sezioni d’urto e la minima soglia
energetica. Si tenga inoltre presente che, al crescere dell’energia dei fotoni
incidenti, la sezione d’urto per la produzione di neutroni aumenta fino a
raggiungere un massimo, intorno alla cosiddetta regione di risonanza gigante, e
poi decresce con l’ulteriore aumento di Eg .
La radioattività prodotta nell’aria della sala di trattamento, a seguito di reazioni fotonucleari di tipo (g,1n), è essenzialmente dovuta all’ 15O ed all’ 13N (Kase, 1967); tali radionuclidi, che risultano essere degli emettitori b+, vengono rispettivamente generati a partire dagli isotopi stabili 16O e 14N. Le energie di soglia per tali reazioni sono pari rispettivamente a 10,5 MeV per l’azoto e 15,7 MeV per l’ossigeno. Inoltre, i periodi di dimezzamento T1/2 di 15O e 13N risultano rispettivamente essere pari a 122 secondi e 10 minuti.
Poiché la misura della radioattività di campioni di aria è stata condotta in ambienti in cui sono utilizzati fasci di radiazioni di energia massima inferiore a 25 MeV, si sono trascurate le reazioni (g,2n) con l’ossigeno, ipotizzando dunque che il 15O sia il radioisotopo predominante formato a partire dal 16O. In particolare, l’attività prodotta in aria è stata determinata a partire dai livelli di attivazione di alcuni campioni contenenti una soluzione di acqua distillata e nitrato di ammonio precedentemente irraggiata con fasci di raggi x (di frenamento) di energia massima pari a 18 MeV prodotti da un linac Saturne 43, utilizzando un’apertura del campo pari a 20x20 cm2 ed una distanza tra la sorgente e la superficie del campione di 100 cm.
Considerando che l’attività di un materiale fotoattivato dipende dalla sua massa, dalla dose assorbita, dalla durata dell’irraggiamento ed anche dal tempo trascorso dal termine della stessa (Lucci et al., 1974), le attività dei due radioisotopi presenti nei campioni esaminati, sono state determinate (mediante la catena spettrometrica al Ge-Li e il contatore proporzionale RADOS) subito dopo l’irraggiamento.
In Appendice A si è riportata la procedura per la determinazione della concentrazione di attività C, ossia l’attività dei due radionuclidi in questione, prodotta per unità di volume d’aria, all’interno della sala di trattamento. In tale valutazione si è considerato un volume interno del bunker pari a 120 m3 , una ventilazione pari 0,3 m3/s (corrispondente a 10 ricambi d’aria l’ora all’interno della sala) ed una quantità di unità monitor (U.M.) erogata dall’acceleratore lineare di 400 U.M. per ciascun trattamento con un rateo di dose a 100 cm dalla sorgente di 2 Gy/min (200 U.M./min).
In tali condizioni, le concentrazioni di attività C di 15O e 13N al termine di un trattamento sono risultate pari rispettivamente a 335 e 1025 Bq/m3.
Poiché i periodi di dimezzamento degli isotopi 15O e 13N sono relativamente brevi si può dimostrare che, nel normale utilizzo clinico dell’acceleratore, la concentrazione di attività presente nell’aria, al termine di N cicli di trattamento (ciascuno di durata Tc= Tr+Ts dove con Tr si è indicato il tempo di irraggiamento e con Ts il tempo di permanenza dell’operatore nella sala di trattamento) sarà dovuta quasi completamente agli ultimi quattro o cinque trattamenti.
Dai valori delle concentrazioni massime ammissibili (CMA) in aria per gli operatori sanitari di 15O e 13N, ottenute sulla base di opportuni modelli (nelle condizioni che approssimano quelle di una sala di trattamento) da Holloway e Cormack (1980), (tabella 1 di Appendice A) e dai limiti di rateo di dose equivalente, DL , (tabella 1 di Appendice A) si può stimare la dose equivalente assorbita , EN , dal personale sanitario operante in un bunker radioterapico, dovuta a N cicli di irradiazione di durata Tr , intervallati da altrettante fasi di centratura del paziente e posizionamento degli accessori di durata Ts. Nel calcolo della dose equivalente si è ipotizzato che la durata di Tr e di Ts sia rispettivamente pari a 2 e 10 minuti.
Ipotizzando un carico di lavoro giornaliero pari a N=40 cicli o trattamenti con fasci di raggi x da 18 MV per cinque giorni alla settimana per 40 settimane, è stato possibile stimare la dose equivalente annua assorbita dagli operatori, derivante dall’attivazione dell’aria all’interno della sala di trattamento e dovuta ai positroni emessi dai due radionuclidi presi in esame. Per un’erogazione di 400 U.M. per ciascun trattamento (con un rateo di dose a 100 cm dalla sorgente di 2 Gy/min), si sono sommati i contributi di dose equivalente (assorbita essenzialmente dalla cute) relativi ai due radioisotopi ottenendo un valore pari a 93 mSv/anno (Appendice A), mentre non si superano i 300 mSv/anno nel caso di ventilazione dell’aria assente.
Si può quindi concludere che la dose equivalente assorbita dalla cute degli operatori dovuta alla sola attivazione dell’aria all’interno della sala di trattamento rappresenta una frazione trascurabile del limite di 500 mSv/anno raccomandato dal D. Lgs. 230/95 per gli operatori classificati in categoria A.
La radioattività indotta nelle
schermature sagomate personalizzate e nei filtri a cuneo
Misure eseguite con il contatore proporzionale RADOS e con la camera a ionizzazione SmartION, hanno confermato che, dopo un irraggiamento con fasci di raggi x da 18 MV, le schermature sagomate personalizzate utilizzate durante i trattamenti radioterapici possono mostrare un livello significativo di radioattività indotta.
In particolare, sono stati presi in esame schermi sagomati personalizzati, realizzati con una lega metallica a basso punto di fusione denominata cerrobend (composta da bismuto (50%), piombo (27%), stagno (13%) e cadmio (10%)).
Analizzando, a seguito dell’irraggiamento, gli spettri di emissione degli elementi
costituenti tali schermi personalizzati (mediante catena spettrometrica al Ge-Li), si è focalizzata l’attenzione sui possibili prodotti di attivazione derivanti dalle reazioni tra i fotoni di alta energia ed i nuclei stabili di tali elementi. Si è quindi verificata la consistenza dei risultati ottenuti dalla spettrometria in emissione dal cerrobend con i dati di letteratura (tabella 2 di Appendice B) pubblicate da Lederer e Shirley (1978).
Per la stima del rateo di dose in
prossimità dei blocchi personalizzati sono state utilizzate, per ogni
irradiazione sagome di cerrobend.
Sono state effettuate, mediante il contatore proporzionale RADOS e la camera a ionizzazione SmartION, due serie di misure al fine di separare la frazione di dose dovuta alle emissioni di radiazione b da quella derivante dalle emissioni di radiazione g. Nella prima serie di misure i due rivelatori sono stati appoggiati direttamente sullo schermo di cerrobend, mentre nella seconda serie di misure si è frapposto uno spessore in perspex di 5 mm (in modo da assorbire la radiazione b di energia inferiore a 1,5 MeV)(ICRU, 1984) tra la superficie della schermatura sagomata e il rivelatore medesimo. I risultati ottenuti interponendo l’assorbitore in perspex hanno mostrato che i conteggi, determinati mediante il contatore proporzionale RADOS, si riducono del 85 % mentre la dose equivalente determinata mediante la camera a ionizzazzione SmartION si riduceva del 90%. Pertanto si è potuto stimare un rateo di dose equivalente da attribuire alle radiazioni b con energia minore di 1,5 MeV pari a 40 mSv/h ed un rateo di dose equivalente di 4 mSv/h per la componente g. L’accuratezza di tali misure è stata stimata essere dell’ordine del 50%.
In base all’accordo di questi risultati con quelli ottenuti da Maspero (1994), si riportano di seguito i valori di dose equivalente ottenuti da quest’ultimo autore per filtri a cuneo in piombo e in acciaio irraggiati con fasci di raggi x da 18 MV. Misure con detti filtri non sono possibili con l’acceleratore Saturne 43 che dispone di un solo filtro a cuneo fisso all’interno della testata e la cui attivazione è stata considerata nel paragrafo successivo.
Il rateo di dose equivalente dovuto all’irraggiamento di filtri a cuneo sopra menzionati sono stati stimati (Maspero, 1994) essere di 60 mSv/h da attribuire alle radiazioni b con energia minore di 1,5 MeV e di 4 mSv/h da attribuire alla componente g.
In generale in base anche ai risultati riportati in letteratura si è osservato che, nell’intervallo di dose normalmente impiegato nella pratica clinica, l’attivazione dei filtri a cuneo e del cerrobend dipende in modo quasi lineare dalla dose e ciò è in accordo con il fatto che i tempi di irradiazione sono piccoli se confrontati con i periodi di dimezzamento dei radionuclidi prodotti.
I risultati qui riportati sono stati ottenuti trascurando l’effetto di crescita della radioattività indotta dovuto alla ripetizione dei trattamenti nell’arco della medesima giornata. A tale riguardo bisogna considerare che nell’impiego clinico, ciascun blocco di cerrobend risulterà di norma irraggiato con una frequenza giornaliera, poiché esso viene conformato in modo da adattarsi al trattamento di un singolo paziente. Tenendo conto del periodo di dimezzamento complessivo della radioattività indotta in questo materiale (T1/2 = 44 minuti), si può ragionevolmente ritenere che non vi sia alcuna crescita di radioattività da un trattamento all’altro e che essa sia determinata esclusivamente dall’ultima irradiazione ricevuta.
Per i filtri a cuneo si deve invece considerare la possibilità di irradiazioni ripetute nell’arco della stessa giornata in quanto il medesimo cuneo può essere impiegato per più di un paziente. Quindi ipotizzando di irraggiare lo stesso filtro per più trattamenti consecutivi, la radioattività indotta in esso aumenterà progressivamente e dipenderà oltre che dalla dose ricevuta per ciascun irraggiamento anche dalla frequenza di ripetizione degli irraggiamenti stessi. In base a misure effettuate con un contatore proporzionale (Maspero, 1994), i periodi di dimezzamento dell’attività indotta nel filtro in piombo e nel filtro in acciaio sono risultati rispettivamente pari a 20 e 10 minuti.
Si può facilmente verificare che la radioattività indotta nei filtri a cuneo, a seguito di irraggiamenti ripetuti, è significativamente maggiore dell’attività indotta a seguito di un’irradiazione singola solo se l’intervallo tra le esposizioni è breve. In particolare per i filtri in piombo si hanno incrementi apprezzabili (maggiori del 10%) per intervalli inferiori a 40 minuti, mentre per i filtri in acciaio saranno necessari tempi più brevi.
In conclusione, i ratei di dose equivalente misurati sulla superficie degli accessori, dovuti alla presenza di filtri a cuneo e di schermi sagomati, sono determinati in gran parte dalle emissioni b e possono essere stimati uguali a circa 100 mSv/h. Ipotizzando un tempo medio di esposizione di 30 secondi per ciascun trattamento ed un’attività lavorativa di 40 trattamenti giornalieri (un terzo dei quali con fasci di raggi x da 18 MV) per 5 giorni alla settimana per 40 settimane all’anno, la dose assorbita dalle mani dell’operatore risulta inferiore a 2,5 mSv/anno, molto al di sotto del limite raccomandato dal D. Lgs. 230/95 di 500 mSv/anno per gli operatori classificati in categoria A.
La radioattività indotta dalle parti costituenti l’acceleratore
La radioattività indotta in un materiale irraggiato con fasci di fotoni od elettroni di alta energia dipende direttamente dal rateo della fluenza delle particelle incidenti (Ahlgren e Olsson, 1988). Al termine di ciascun trattamento, le parti costituenti la testa dell’acceleratore ed il target saranno fonti di radioattività indotta.
La spettrometria gamma realizzata con la catena spettrometrica Ge-Li, in corrispondenza della testa dell’acceleratore Saturne 43 ha mostrato, tra gli altri, un picco a 511 keV dovuto alla reazione di annichilazione dei b+ emessi dal 62Cu (Ahlgren e Olsson, 1988): tale radionuclide, avente un periodo di dimezzamento pari a 9,7 minuti, è prodotto (a partire dal 63Cu), mediante reazioni fotonucleari, nel supporto in rame del target.
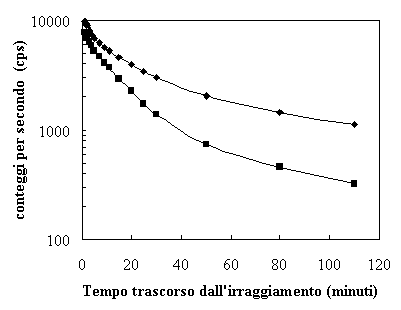
Nel computo della radiazione indotta dalle parti costituenti la testa dell’acceleratore compreso il filtro a cuneo fisso all’interno del Saturne 43, alla fine di una settimana di trattamenti, possono giocare un ruolo non del tutto trascurabile i radionuclidi a lungo periodo di dimezzamento (quali ad esempio il 187W che ha un T1/2 pari a 23,8 ore). Al fine di valutare il periodo di dimezzamento dei radionuclidi attivati, mediante il contatore RADOS sono stati determinati in prossimità della testata dell’acceleratore i conteggi a tempi diversi (figura 5 di Appendice C).
Le dosi equivalenti dovute alle radiazioni b e g sono state stimate separatamente con la stessa modalità impiegata per valutare le emissioni dal cerrobend. In particolare, il contributo di dose maggiore è offerto dalle radiazioni b mentre la dose dovuta alle radiazioni g rappresenta circa il 45% del totale.
Le dosi equivalenti rilevate, a seguito di un'erogazione dell'acceleratore lineare di 1000 U.M. (con un rateo di dose a 100 cm dalla sorgente di 2 Gy/min e con un campo di 40x40 cm2), in tre punti ritenuti maggiormente significativi per la stima dell’esposizione del personale sono risultate pari a:
· 24 mSv/h a contatto della superficie della finestra di uscita del fascio dell'acceleratore (componente b+g)
· 6 mSv/h all’isocentro (componente g)
· 4 mSv/h a 30 cm dall’asse del fascio (componente g)
In generale i ratei di dose più elevati si registrano in corrispondenza della finestra d’uscita del fascio poiché, in tale regione, le radiazioni emesse dal target non sono schermate (come invece accade in tutte le altre direzioni).
Ipotizzando un tempo di esposizione di 5 minuti ad un rateo di 6 mSv/h per ciascun trattamento ed un’attività lavorativa di 10 trattamenti giornalieri con fasci di raggi x da 18 MV per 5 giorni alla settimana per 40 settimane all’anno, la dose equivalente all’operatore risulta pari a 0,6 mSv/anno inferiore al limite raccomandato dal D. Lgs. 230/95 di 20 mSv/anno per gli operatori classificati in categoria A.
Linee guida
La radioattività indotta nei componenti e negli accessori di un acceleratore lineare per uso clinico può contribuire all’esposizione degli operatori sanitari che hanno accesso alle sale di trattamento radioterapico, quando vengono utilizzati fasci di radiazioni di energia superiore a 10 MeV. In generale, la quantità di radioattività indotta dipende oltre che dal rateo di emissione delle radiazioni anche dalla loro energia e dalla durata dell’irraggiamento. Ciò è confermato dai risultati ottenuti dalle misure condotte, nell’ambito del presente lavoro, presso il Policlinico Gemelli dell’Università Cattolica del Sacro Cuore (UCSC) di Roma, ove sono istallati acceleratori lineari di alta energia.
Le fonti di esposizione da radioattività indotta per gli operatori sanitari ritenute più significative, sono:
- l’aria presente nella sala di trattamento;
- gli accessori per la modifica del fascio normalmente impiegati nei trattamenti radioterapici (filtri a cuneo e schermi sagomati personalizzati);
- le componenti dell’acceleratore.
Dai risultati ottenuti si è potuto constatare che l’attivazione dell’aria all’interno della sala di trattamento non comporta un rischio significativo per gli operatori, sia perché le quantità di radioattività indotta sono modeste, sia perché i tempi di dimezzamento dei radionuclidi generati sono estremamente brevi. In particolare, la stima della dose equivalente annua assorbita dalla cute degli operatori, dovuto ai positroni emessi dall’ 15O e dall’ 13N , è risultata di circa 300 mSv/anno in assenza di ventilazione mentre tale valore è inferiore a 0,1 mSv/anno (93 mSv/anno) in presenza di ventilazione corrispondente a 10 ricambi d’aria ogni ora all’interno della sala di trattamento, molto al di sotto del limite fissato dal D. Lgs. 230/95 di 500 mSv/anno per gli operatori classificati in categoria A.
-
E’
quindi buona norma controllare la corretta ventilazione dell’aria.
Le maggiori fonti di esposizione del personale sono costituite dai componenti stessi dell’acceleratore e dagli accessori usati nei trattamenti radioterapici, quali filtri a cuneo e schermi sagomati personalizzati.
Per quanto riguarda l’esposizione delle mani degli operatori, bisogna considerare che il maggior contributo deriva dalla manipolazione dei filtri a cuneo e dei blocchi sagomati personalizzati. I ratei di esposizione misurati alla superficie di tali accessori sono dovuti in gran parte alle emissioni b, e nelle condizioni lavorative più cautelative la dose equivalente alla cute delle mani dell’operatore è risultata inferiore a 2,5 mSv/anno cioè una frazione del limite raccomandato dal D. Lgs. 230/95, di 500 mSv/anno, per gli operatori classificati in categoria A.
-
E’
quindi buona norma:
a) mantenere
lontani dai fasci di radiazioni tutti gli accessori non utilizzati in un
trattamento radioterapico al fine di evitarne l’attivazione.
b) limitare l’uso
dei materiali che presentano elevata produttività di attivazione (come ad
esempio l’alluminio).
Per quanto riguarda il contributo di dose relativo ai componenti dell’acceleratore, i valori maggiori di rateo di dose equivalente si sono registrati in prossimità della finestra di uscita del fascio di radiazioni dovuti al 62Cu prodotto nel target.
La dose equivalente all’operatore dovuta all’emissione di radiazione g proveniente dai soli componenti dell’acceleratore è risultata pari a 0,6 mSv/anno, inferiore al limite raccomandato dal D. Lgs. 230/95, di 20 mSv/anno, per gli operatori classificati in categoria A.
-
E’
buona norma operare nella modalità corretta per la centratura del paziente ed
evitare di sostare inutilmente in prossimità della testata dell’acceleratore.
Appendici
Appendice A
Analisi delle misure di
radioattività indotta nell’aria di una sala di trattamento radioterapico
L’attività prodotta nell’aria di una sala di trattamento, dove è operante un acceleratore Saturne 43, è stata valutata a partire dai livelli di attivazione di alcuni campioni di acqua distillata e di nitrato di ammonio irraggiati con fasci di raggi x di energia massima pari a 18 MeV (Kase, 1967; Maspero, 1994).
I campioni sono stati immessi in contenitori di plastica di 250 cm2 di sezione , posti perpendicolarmente all’asse del fascio e riempiti fino ad un livello di 0,5 cm. Al termine dell’irraggiamento, il liquido è stato rimescolato e ne è stato prelevato un campione di 10 cm3 .
Al fine di determinare le attività dei radioisotopi (15O e 13N) presenti nei campioni subito dopo l’irraggiamento, in una prima fase, mediante la catena spettrometrica al Ge-Li, sono stati individuati gli spettri di emissione dei due radionuclidi. Mediante contatore proporzionale RADOS sono stati determinati i ratei di conteggio a istanti di tempo prefissati, che hanno permesso di determinare le relative curve di decadimento mostrate in figura 1. I ratei di conteggio dei due singoli radioisotopi sono stati ottenuti subito dopo l’irraggiamento determinando per estrapolazione al tempo zero, le curve di decadimento. Quindi dai conteggi al tempo iniziale si sono determinate le attività, A, dei due radionuclidi, in quanto il contatore proporzionale RADOS era stato opportunamente tarato in termini di disintegrazioni al secondo (Bq).

Fig.1 Curva
di decadimento del nitrato di ammonio (NH4NO3). Con
il simbolo (u)sono indicati i conteggi relativi al radionuclide 15O
, con il simbolo (n) quelli
relativi al 13N, mentre i conteggi totali sono indicati con il simbolo
(ê).
Il
rateo di produzione P di attività indotta per chilogrammo di ossigeno 15O
e di azoto 13N, a seguito di un irraggiamento di durata infinita con
un rateo di dose pari a 100 cGy/min è stato determinato dalla relazione:
![]() (2)
(2)
dove:
![]() (l),
espresso in mGy/s , è il rateo di dose ad una distanza l dalla sorgente;
(l),
espresso in mGy/s , è il rateo di dose ad una distanza l dalla sorgente;
16,7 è un fattore di conversione da mGy/s a cGy/min, tenendo conto che P è in effetti il rateo di produzione dei radionuclidi a seguito di un irraggiamento infinito ottenuto con un rateo di dose di 100 cGy/min;
Ma(l) è la massa (espressa in kg) dell’ossigeno o dell’azoto contenuta in un volume di aria a distanza l dalla sorgente (vedi figura 2);
V’=V·(l+l’)/l essendo V il volume d’aria nella sala di trattamento espresso in m3 (pari a 120 m3);
l’=v/V, con v la velocità di rimozione dell’aria dalla sala di trattamento espressa in m3/s (pari a 0,3 m3/s), Ts è il tempo di permanenza dell’operatore all’interno del bunker radioterapico stimato di 10 minuti (600 s), necessario alla predisposizione di un singolo trattamento.
0
L’impiego dell’espressione (2) comporta le seguenti
ipotesi:
a)
la ventilazione
d’aria all’interno della sala di trattamento consente una omogeneizzazione
della distribuzione dei radionuclidi, tale che la massa d’aria coinvolta
nell’irraggiamento, schematizzato in figura 2, al termine del tempo di
irraggiamento, Tr , occupi un volume molto maggiore di V1
cioè il volume interessato all’irraggiamento stesso;
b) la produzione di 15O e 13N per unità di massa di ossigeno e di azoto proporzionale al rateo dose che segue la legge dell’inverso del quadrato delle distanze dalla sorgente:

dove:
![]() (l)
è il rateo di dose ad una distanza l dalla sorgente;
(l)
è il rateo di dose ad una distanza l dalla sorgente;
![]() (l0)
è il rateo di dose (pari a 33 mGy/s) al build-up per una distanza l0
dalla sorgente di 100 cm.
(l0)
è il rateo di dose (pari a 33 mGy/s) al build-up per una distanza l0
dalla sorgente di 100 cm.
Tenendo conto di quanto finora esposto, le concentrazioni di attività C di 15O e 13N al termine di un trattamento sono risultate pari rispettivamente a 335 e 1025 Bq/m3.
Si può dedurre dall’espressione (2) che l’attività dipende dal rateo di dose impiegato, dalla durata dell’irraggiamento e dal tempo trascorso dal termine dello stesso.
In tabella 1, per i radioisotopi 13N e 15O, sono riportati, sulla base di opportuni modelli (Holloway e Cormack , 1980) e nelle condizioni che approssimano quelle di un bunker radioterapico ove è istallato un acceleratore lineare, i valori di concentrazioni massime ammissibili (CMA) ed i relativi limiti di rateo di dose equivalente, DL. Tali stime sono ottenute per un attività lavorativa degli operatori sanitari di 40 ore settimanali.
|
Radioisotopo |
Organo interessato |
DL (nSv/s) |
CMA (aria) (40 ore /sett.) (MBq/m3) |
Radiazione |
|
13N |
Cute |
41,7 |
1,48 |
Positroni |
|
13N |
Corpo intero |
6,95 |
8,51 |
Annichilazione |
|
15O |
Cute |
41,7 |
1,07 |
Positroni |
|
15O |
Corpo intero |
6,95 |
8,51 |
Annichilazione |
Sulla base dei limiti riportati in tabella 1 è possibile quindi stimare la dose equivalente, E , (espresso in nSv) assorbita per un singolo trattamento dagli operatori sanitari che permangono nella sala di trattamento per un tempo Ts subito dopo un irraggiamento di durata Tr:
 (3)
(3)
dove:
![]() rappresenta
il rateo di dose equivalente, espresso in nSv/s, dopo l’irraggiamento di durata
Tr ed è espresso dal rapporto:
rappresenta
il rateo di dose equivalente, espresso in nSv/s, dopo l’irraggiamento di durata
Tr ed è espresso dal rapporto:
![]()
dove C0 è la concentrazione di attività (in aria) dei radionuclidi espressa in Bq/m3 dopo l’irraggiamento di durata Tr:
![]()
Integrando l’espressione (3) si ottiene
00000000000000000000000000000![]() (4)
(4)
Sommando infine i contributi relativi ai due radioisotopi, si è ottenuto che, per un’erogazione di 400 U.M. (con un rateo di dose a 100 cm dalla sorgente di 2 Gy/min), la dose equivalente complessiva assorbita per un singolo trattamento dagli operatori sanitari è risultata E = 10 nSv.
Dall’espressione (4) si può osservare che il parametro critico della tabella 1 è rappresentato dalla dose alla cute dovuta ai positroni emessi dai due radioisotopi.
Al fine di determinare la dose equivalente, EN , assorbita complessivamente dall’operatore sanitario dopo N cicli di trattamento, ciascuno di durata TC = Tr +Ts (con Tr e Ts pari a 2 e10 minuti rispettivamente), si sono sommati i contributi relativi ai singoli accessi alla sala di trattamento come segue:
![]()
![]() (5)
(5)
con a=l+v/V .
Ipotizzando un carico di lavoro giornaliero pari a N=40 trattamenti con fasci di raggi x da 18 MV per cinque giorni alla settimana, per 40 settimane e nelle condizioni di ricambi d’aria sopra riportate, è stato possibile stimare la dose equivalente annua assorbita dagli operatori sanitari, dovuta ai positroni emessi dai due radionuclidi presi in esame. Sommando i contributi di dose equivalente (assorbita essenzialmente dalla cute) relativi ai due radioisotopi si è ottenuto un valore pari a 93 mSv/anno.
Appendice
B
Analisi delle misure di radioattività
negli accessori utilizzati nella sala di trattamento radioterapico
A seguito di irraggiamenti con fasci di raggi x da 18 MV, prodotti dall’acceleratore Saturne 43, si sono analizzati, mediante catena spettrometrica al Ge-Li, gli spettri di emissione dei principali elementi costituenti il materiale (cerrobend) impiegato per la realizzazione delle schermature sagomate personalizzate utilizzate nelle sale di trattamento radioterapico. Al fine di massimizzare l’area del campione investita dal fascio si è impostata la massima apertura consentita dei collimatori (40x40 cm2).
Si è quindi focalizzata l’attenzione sui possibili prodotti di attivazione derivanti dalle reazioni tra i fotoni di alta energia ed i nuclei stabili di tali elementi.
Nella tabella 2 sono indicate le principali reazioni fotonucleari previste nel cerrobend (Lederer e Shirley , 1978); nella stessa tabella sono altresì riportate le principali energie dei fotoni emessi dai radionuclidi prodotti.
A partire dai conteggi acquisiti, mediante contatore proporzionale RADOS, ad intervalli di tempo successivi sono stati ricavati i periodi di dimezzamento (T1/2) per ciascun radionuclide evidenziato nell’intero spettro di emissione del cerrobend. La stima di 44 minuti del periodo di dimezzamento dell’attività complessiva del cerrobend confermava quanto riportato in letteratura.
|
|
|
Energia beta
|
|
|
|
|
|
|
|
106Cd(g,n)->105Cd
|
1,3
|
1,7
(+)
|
105Cd
|
56’
|
433
|
|
648
|
-
|
|
112Cd(g,n)->111MCd
|
24
|
|
111MCd
|
49’
|
151
|
0,31
|
245
|
0,94
|
|
112Sn(g,n)->111Sn
|
1
|
1,5 (+)
|
111Sn
|
35’
|
340
|
|
761
|
|
|
118Sn(g,p)->117In
|
24
|
0,74
|
117In
|
42’
|
158
|
0,86
|
533
|
0,99
|
|
204Pb(g,n)->203Pb
|
1,4
|
E.C.
|
203Pb
|
52h
|
73
|
0,45
|
279
|
0,77
|
Allo scopo di stimare il rateo di dose in prossimità dei blocchi di cerrobend sono stati impiegati il contatore proporzionale RADOS e la camera a ionizzazione SmartION.
I blocchi sono stati irraggiati impostando diversi valori di unità monitor e diversi ratei di dose (a 100 cm dalla sorgente) affinché si potesse valutare il corrispondente andamento della radioattività indotta. Le figure 3 e 4 mostrano rispettivamente l’attivazione del cerrobend dopo un irraggiamento di 200 e di 500 U.M. determinata mediante il contatore RADOS. Si può notare che, a parità di dose complessiva, l’attivazione finale dei materiali diminuisce leggermente quando si riduce il rateo di dose; tale effetto è inoltre più marcato se l’acceleratore eroga un numero di unità monitor maggiore.

Fig.3 Attivazione del cerrobend dopo irraggiamento di 200 U.M.;
i conteggi relativi alle
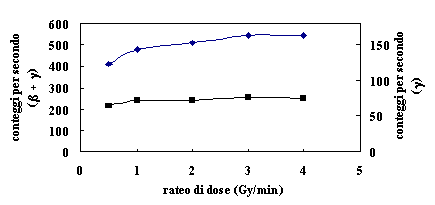
Fig.4 Attivazione del cerrobend dopo irraggiamento di 500 U.M.;
i conteggi relativi alle
I risultati ottenuti interponendo l’assorbitore in perspex hanno mostrato che i conteggi, determinati mediante il contatore proporzionale RADOS, si riducono del 85 % mentre la dose equivalente determinata mediante la camera a ionizzazzione SmartION passava da 45 mSv/h per la componente b+g a 5 mSv/h per la sola componente g. Dato il buon accordo tra le due frazioni misurate con il contatore proporzionale RADOS e la camera a ionizzazione SmartION si è ritenuto opportuno stimare un rateo di dose equivalente da attribuire alle radiazioni b con energia minore di 1,5 MeV, pari a 40 mSv/h ed un rateo di dose equivalente di 4 mSv/h per la componente g. L’accuratezza di tali misure è stata stimata essere dell’ordine del 50%.
Appendice
C
Analisi delle misure di radioattività nelle parti che costituiscono un
acceleratore lineare utilizzato a scopo clinico
Il decadimento dell’attività indotta nella testa dell’acceleratore avviene essenzialmente in due fasi (Nelson e La Riviere, 1984): nella prima, con il prevalere dei radionuclidi con T1/2 breve, si avrà una rapida diminuzione delle emissioni, mentre nella seconda fase, con il prevalere dei radionuclidi con T1/2 più lunghi , il decadimento sarà più lento. Per verificare questo asserto sono stati misurati ratei di conteggio a diversi intervalli di tempo dopo l’irraggiamento, sia in prossimità della finestra di uscita del fascio sia sulla superficie laterale della testa dell’acceleratore.
Dalla figura 5 risulta che i ratei di conteggio rilevati all’uscita del fascio decrescono più rapidamente rispetto a quelli misurati sulla superficie laterale della testa, tale effetto è dovuto al prevalere dei radionuclidi con T1/2 più breve (in particolare al 62Cu contenuto nel target). I periodi di dimezzamento iniziali dei radionuclidi prodotti possono essere stimati a partire dalle curve riportate in figura 5 e sono risultati essere pari a 9 minuti (finestra di uscita del fascio) e 12 minuti (superficie laterale della testa).
Bibliografia
L. Ahlgren
e L.E. Olsson: ‘Induced activity in a high-energy linear accelerator”, Phys.
Med. Biol., vol. 33 n. 3 351-354 (1988).
P.D Allen e M. A. Chaudhri: “The Dose Contribution
Due To Photonuclear Reactions During Radiotherapy”, Med Phys, voI. 9 (1982).
Attuazione delle direttive EURATOM 80/836, 84/467, 84/466, 89/618, 90/641 e 92/3 in materia di radiazioni ionizzanti - D.Lgs 230/95 (Gazz.. Uff. n.136 – 13 giugno 1995).
E. Epp,
J. Laughlin, W. Swanson, V. P. Bond: “Neutrons From High Energy X-Ray
Medical Accelerators: An Estimate Of’ Risk To
The Radiotherapy Patient’, Mcd. Phys, vol.11 n. 3 (1984).
AF. Holloway e D. V. Cormack, Health Physics 38, 673 (1980).
R. J. Hoffman
e R. Nath: “On the sources of radiation exposure of technologistsin a radiotherapy
center with high energy x-ray accelerators”, Health Phys. 42, 525 (1982).
W. Huda,
J. Bews e A.M Sourkes: Occupational Doses in Radiation Oncology in Manitoba
- 1980 to 1986, Health Phys. vol. 57 n. 4 52 1-527 (1989).
K.R. Kase “Radioactive Gas Produetion At A 100
Mev Electron Linac Facility’, Health Physics 13, 869 (1967).
ICRU International Commission on Radiation Units
and Measurements: “Stopping Powers for Electrons and Positrons’, Report n.
37 - 1984.
CM. Lederer e VS. Shirley: “Table of isotopes”,
Wiley New York (1978).
F. Lucci , M. Pelliccioni, A. Rindi “La
radioprotezione intorno agli acceleratori di particelle” – edizioni Minerva
Medica (1974).
Maspero – “La radioattività indotta nell’impiego terapeutico di un acceleratore
lineare di elettroni con energia fino a 20 MeV” , tesi di specializzazione
Univ. Milano (1994).
ICRP - National Council on Radiation Protection
and Measurements: “Neutron Contamination from Medical Electron Accelerators”,
Report n. 79 - 1984.
W.R. Nelson e P.D. La Riviere: “Primary and Leakage
Radiation Calculation at 6, 10 and 25 MeV’, Health Phys vol 47, n. 6 811-818,
(1984).
O’Brien: “Radiation protection aspects of a new
linear accelerator”, Med. Phys. vol.12 n. 1 (1985).
N.L. PoweIl, A. Newing, MA. Bulien, C. Sims e
S.F. Leaton: “A radiation safety survey on a Clinac-20 linear accelerator”,
Phys. Med. Biol., vol. 32 n. 6 707-718 (1987).