Capítulo 4
La Estructura de la
Materia.
Tabla de contenido
Objetivos.
1. Comparar los modelos atómicos de Rutherford y de Bohr.
2. Explicar los importantes desarrollos que condujeron al modelo actual del átomo.
3. Comparar la frecuencia, la longitud de onda y la energía de la radiación electromagnética; los tipos y sus energías relativas.
4. Definir la ionización y da un ejemplo de ella.
5. Dibujar diagramas de Bohr para los primeros 20 elementos.
6. Dibujar símbolos de Lewis para los elementos representativos.
7. Escribir configuraciones electrónicas y diagramas de orbitales para los elementos representativos y algunos metales de transición
8. Relacionar los subniveles y orbitales con la posición en la tabla periódica.
Partículas elementales.
Las partículas elementales se subdividen comúnmente en cuatro tipos. A uno de ellos pertenece una sola partícula: el fotón. El segundo tipo lo forman los leptones, el tercero los mesones, y finalmente, el cuarto tipo, los bariones. Los mesones y los bariones se unen usualmente en un tipo de partículas de interacción fuerte denominadas hadrones.
A continuación daremos una breve descripción de los tipos de partículas enumerados.
- Los fotones (partículas o
cuantos responsables del campo electromagnético), participan en las
interacciones electromagnéticas, pero no poseen interacciones nucleares
fuertes ni débiles.
- Los leptones recibieron
su nombre de la palabra griega leptos, que significa ligeros. A estos
pertenecen las partículas que no poseen interacción fuerte: los muones,
los electrones, los neutrinos electrónicos, y las correspondientes antipartículas
para cada una de estas partículas. Todos los leptones tienen un espín
igual a 1/2 y por consiguiente, son fermiones (partículas de espín
semientero que no pueden encontrarse en el mismo estado con los mismos
números cuánticos) y poseen interacción débil. Aquellos que tienen carga
eléctrica (o sea, los muones y los electrones) poseen también interacción
electromagnética.
- Los mesones son
partículas inestables de interacción fuerte que carecen de la llamada
carga bariónica. A este grupo pertenece los mesones pi o piones, los
mesones K o kaones y el mesón eta. A diferencia de los leptones, los
mesones poseen no sólo interacción débil (y electromagnética, si están
cargados), sino también fuerte, la que se manifiesta durante la
interacción de éstos entre sí y también con los bariones para formar
hadrones. El espín de todos los mesones es igual a cero, de manera que
todos ellos son bosones, que contrariamente a los fermiones, pueden
acumularse en un estado.
- Los bariones agrupan a
los nucleones (protón, neutrón) y unas partículas inestables, que poseen
mayor masa que la de los nucleones, denominados hiperones. Todos los
bariones poseen interacción fuerte y, por consiguiente interaccionan
activamente con los núcleos atómicos. El espín de todos los bariones es
igual a 1/2, de forma que los mismos son fermiones. Salvo el protón todos
los bariones son inestables. Desintegrándose junto con otras partículas
dan obligatoriamente un barión.
Modelo Atómico de Dalton
Aproximadamente por el año 1808, Dalton define a los átomos como la unidad constitutiva de los elementos (retomando las ideas de los atomistas griegos). Las ideas básicas de su teoría, publicadas en 1808 y 1810 pueden resumirse en los siguientes puntos:
·
La
materia está formada por partículas muy pequeñas para ser vistas, llamadas
átomos.
·
Los
átomos de un elemento son idénticos en todas sus propiedades, incluyendo el
peso.
·
Diferentes
elementos están formados por diferentes átomos.
·
Los
compuestos químicos se forman de la combinación de átomos de dos o más elementos,
en un átomo compuesto; o lo que es lo mismo, un compuesto químico es el
resultado de la combinación de átomos de dos o más elementos en una proporción
numérica simple.
- Los átomos son
indivisibles y conservan sus características durante las reacciones
químicas.
- En cualquier
reacción química, los átomos se combinan en proporciones numéricas
simples.
- La separación de
átomos y la unión se realiza en las reacciones químicas. En estas
reacciones, ningún átomo se crea o destruye y ningún átomo de un elemento
se convierte en un átomo de otro elemento.
A pesar de que la teoría de Dalton era errónea en varios aspectos, significó un avance cualitativo importante en el camino de la comprensión de la estructura de la materia. Por supuesto que la aceptación del modelo de Dalton no fue inmediata, muchos científicos se resistieron durante muchos años a reconocer la existencia de dichas partículas.
Además de sus postulados Dalton empleó diferentes símbolos para representar los átomos y los átomos compuestos, las moléculas.
Sin embargo, Dalton no elabora ninguna hipótesis acerca de la estructura de los átomos y habría que esperar casi un siglo para que alguien expusiera una teoría acerca de la misma.
Otras Leyes que concordaban con la teoría de Dalton:
·
Ley de la Conservación de la Masa: La materia no
se crea ni se destruye, sólo se transforma.
·
Ley de las Proporciones Definidas: Un compuesto
puro siempre contiene los mismos elementos combinados en las mismas
proporciones en masa.
·
Ley de las Proporciones Múltiples: Cuando dos
elementos A y B forman más de un compuesto, las cantidades de A que se combinan
en estos compuestos, con una cantidad fija de B, están en relación de números
pequeños enteros.
Modelo Atómico de Thomson
Thomson sugiere un modelo atómico que tomaba en cuenta la existencia del electrón, descubierto por él en 1897. Su modelo era estático, pues suponía que los electrones estaban en reposo dentro del átomo y que el conjunto era eléctricamente neutro. Con este modelo se podían explicar una gran cantidad de fenómenos atómicos conocidos hasta la fecha. Posteriormente, el descubrimiento de nuevas partículas y los experimentos llevados a cabo por Rutherford demostraron la inexactitud de tales ideas.
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas.
Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva.
En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.
Modelo Atómico de Rutherford
Basado en los resultados de su trabajo, que demostró la existencia del núcleo atómico, Rutherford sostiene que casi la totalidad de la masa del átomo se concentra en un núcleo central muy diminuto de carga eléctrica positiva. Los electrones giran alrededor del núcleo describiendo órbitas circulares. Estos poseen una masa muy ínfima y tienen carga eléctrica negativa. La carga eléctrica del núcleo y de los electrones se neutraliza entre sí, provocando que el átomo sea eléctricamente neutro.
El modelo de Rutherford tuvo que ser abandonado, pues el movimiento de los electrones suponía una pérdida continua de energía, por lo tanto, el electrón terminaría describiendo órbitas en espiral, precipitándose finalmente hacia el núcleo. Sin embargo, este modelo sirvió de base para el modelo propuesto por su discípulo Niels Bohr, marcando el inicio del estudio del núcleo atómico, por lo que a Rutherford se le conoce como el padre de la era nuclear.
Ernest Rutherford estudió los componentes de la radiación que ocurre espontáneamente en la Naturaleza.
En 1900 Rutherford, con la colaboración de Geiger Marsden, soporta y verifica su teoría con el experimento, hoy muy famoso, de la lámina de oro. El experimento era simple, bombardearon una placa de oro muy delgada con partículas alfa procedentes de una fuente radioactiva. Colocaron una pantalla de sulfuro de zinc fluorescente por detrás de la capa de oro para observar la dispersión de las partículas alfa en ellas.
Lo anterior demostró, que la dispersión de partículas alfa con carga positiva, era ocasionada por repulsión de centros con carga positiva en la placa de oro, igualmente se cumplía con placas de metales distintos, pudiéndose concluir que cada átomo contenía un centro de masa diminuto con carga positiva que denominó núcleo atómico. La mayoría de las partículas alfa atraviesan las placas metálicas sin desviarse, porque los átomos están constituidos, en su mayoría, por espacios vacíos colonizados tan sólo por electrones muy ligeros. Las pocas partículas que se desvían son las que llegan a las cercanías de núcleos metálicos pesados con cargas altas.
Gracias a estos desarrollos experimentales de Rutherford, éste pudo determinar las magnitudes de las cargas positivas de los núcleos atómicos. Los cálculos que se basan en los resultados del experimento indican que el diámetro de la "porción desocupada" del átomo es de 10.000 a 100.000 veces mayor que el diámetro del núcleo.
Aspectos más importantes del Modelo atómico de Ernest Rutherford:
·
El
átomo posee un núcleo central en el que su masa y su carga positiva.
·
El
resto del átomo debe estar prácticamente vacío, con los electrones formando una
corona alrededor del núcleo.
·
La
neutralidad del átomo se debe a que la carga positiva total presente en el
núcleo, es igualada por el número de electrones de la corona.
·
Cuando
los electrones son obligados a salir, dejan a la estructura con carga positiva
(explica los diferentes rayos).
·
El
átomo es estable, debido a que los electrones mantienen un giro alrededor del
núcleo, que genera una fuerza centrifuga que es igualada por la fuerza
eléctrica de atracción ejercida por el núcleo, y que permite que se mantenga en
su órbita.
·
El
valor de la cantidad de energía contenida en un fotón depende del tipo de
radiación (de la longitud de onda). En la medida que la longitud de onda se
hace menor, la cantidad de energía que llevan es mayor.
·
En
la región 7.5x1014 hasta 4.3x10-14 se encuentra el
espectro visible, con los colores violeta, azul, verde, amarillo y rojo.
·
Las
regiones donde las frecuencias son mayores (longitud de onda es menor), el
contenido energético de los fotones, es grande en comparación con otras zonas.
·
En
el caso de la luz ultravioleta (U.V.) sus radiaciones no se perciben a simple
vista, pero conocemos su alto contenido energético al actuar como catalizador
en numerosos procesos químicos.
Longitud de onda: Distancia entre dos crestas en una onda (Longitud de un ciclo)
Velocidad de la luz: 2.998 x 108 cm/s
Frecuencia: Número de ondas que pasan por un punto en un segundo.
Modelo Atómico de Bohr
El físico danés Niels Bohr (Premio Nobel de Física 1922), postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. El electrón puede acceder a un nivel de energía superior, para lo cual necesita "absorber" energía. Para volver a su nivel de energía original es necesario que el electrón emita la energía absorbida (por ejemplo en forma de radiación). Este modelo, si bien se ha perfeccionado con el tiempo, ha servido de base a la moderna física nuclear. Este propuso una Teoría para describir la estructura atómica del Hidrógeno, que explicaba el espectro de líneas de este elemento. A continuación se presentan los postulados del Modelo Atómico de Bohr:
· El átomo de Hidrógeno contiene un electrón y un núcleo que consiste de un sólo protón. · El electrón del átomo de Hidrógeno puede existir solamente en ciertas órbitas esféricas las cuales se llaman niveles o capas de energía. Estos niveles de energía se hallan dispuestos concéntricamente alrededor del núcleo. Cada nivel se designa con una letra (K, L, M, N,...) o un valor de n (1, 2, 3, 4,...).
- El electrón posee
una energía definida y característica de la órbita en la cual se mueve. Un
electrón de la capa K (más cercana al núcleo) posee la energía más baja
posible. Con el aumento de la distancia del núcleo, el radio del nivel y
la energía del electrón en el nivel aumentan. El electrón no puede tener
una energía que lo coloque entre los niveles permitidos.
- Un electrón en la
capa más cercana al núcleo (Capa K) tiene la energía más baja o se
encuentra en estado basal. Cuando los átomos se calientan, absorben
energía y pasan a niveles exteriores, los cuales son estados energéticos
superiores. Se dice entonces que los átomos están excitados.
- Cuando un electrón
regresa a un nivel inferior emite una cantidad definida de energía a la
forma de un cuanto de luz. El cuanto de luz tiene una longitud de onda y
una frecuencia características y produce una línea espectral
característica.
- La longitud de onda
y la frecuencia de un fotón producido por el paso de un electrón de un
nivel de energía mayor a uno menor en el átomo de Hidrógeno está dada por:
- Para Bohr el átomo
sólo puede existir en un cierto número de estados estacionarios, cada uno
con una energía determinada.
- La energía sólo
puede variar por saltos sucesivos, correspondiendo cada salto a una
transición de un estado a otro. En cada salto el átomo emite luz de
frecuencia bien definida dada por:
hv = | Ei - Ei |
De esta manera se explican los espectros atómicos, que en el caso del Hidrógeno los niveles de energía posibles están dados por la fórmula:
E = - (h/R)/n2, (n = 1, 2, 3,. . . infinito)
h = 6,0625 x 10-34 Joule - s, Constante de Plank
R = 1,10 x 107 m-1, Constante de Rydberg
El modelo de Niels Bohr, coincide con el propuesto por Rutherford, admite la presencia de un núcleo positivo que contiene, prácticamente, toda la masa del átomo, donde se encuentran presentes los protones y los neutrones.
Los electrones con carga negativa, se mueven alrededor del núcleo en determinados niveles de energía, a los que determinó estados estacionarios, y les asignó un número entero positivo. El nivel más cercano tiene el número 1, le sigue el 2, como se citó en párrafo de éste mismo enunciado (Modelo atómico de Bohr).
Siempre que el electrón se mantenga en la órbita que le corresponde, ni gana ni pierde energía. Si un electrón salta de una órbita a otra capta o libera energía en forma de fotones. La cantidad viene dada por la diferencia de energía entre los dos (2) niveles.
La energía de cada nivel es mayor en la medida que se aleja del núcleo; sin embargo, las diferencias entre los niveles van disminuyendo, lo que permite que las transiciones electrónicas se produzcan con facilidad.
El número de electrones de cada elemento en su estado natural es característico, puesto que depende de su número atómico. Estos electrones estarán distribuidos en diferentes niveles energéticos que pueden funcionar como estaciones de paso para aquellos que reciben suficiente energía para saltar de un nivel a otro. Al devolverse, la luz que, difractada, produce el espectro característico.
Principios de incertidumbre
Para poder estudiar las propiedades de un átomo y de sus partículas constituyentes, es necesario iluminarlo; es decir lograr la incidencia de luz sobre él; esto trae un cambio en su contenido energético y, a su vez en la posición. En otras palabras: el estudio del átomo lleva un error necesario que nos impide hablar con certeza de la posición o contenido energético del mismo.
Esto imposibilita presentar un átomo como hasta el momento se ha hecho, puesto que se puede describir un espacio donde es muy probable encontrar un electrón, pero no se puede excluir la posibilidad de que se encuentre en otro lugar.
Según el principio de incertidumbre no se puede conocer con exactitud la posición del electrón ni su contenido energético. Esto obliga a usar un nuevo término, "probabilidad", para la descripción del átomo.
Modelo Atómico actual
Entre los conocimientos actuales o no sobre el átomo, que han mantenido su veracidad, se consideran los siguientes:
1. La presencia de un núcleo atómico con las partículas conocidas, la casi totalidad de la masa atómica en un volumen muy pequeño.
2. Los estados estacionarios o niveles de energía fundamentales en los cuales se distribuyen los electrones de acuerdo a su contenido energético.
3. La dualidad de la materia (carácter onda-partícula), aunque no tenga consecuencias prácticas al tratarse de objetos de gran masa. En el caso de partículas pequeñas (electrones) la longitud de onda tiene un valor comparable con las dimensiones del átomo.
4. La probabilidad en un lugar de certeza, en cuanto a la posición, energía y movimiento de un electrón, debido a la imprecisión de los estudios por el uso de la luz de baja frecuencia.
Fue Erwin Schrödinger, quien ideó el modelo atómico actual, llamado "Ecuación de Onda", una fórmula matemática que considera los aspectos anteriores. La solución de esta ecuación, es la función de onda (PSI), y es una medida de la probabilidad de encontrar al electrón en el espacio. En este modelo, el área donde hay mayor probabilidad de encontrar al electrón se denomina orbital.
El valor de la función de onda asociada con una partícula en movimiento está relacionada con la probabilidad de encontrar a la partícula en el punto (x,y,z) en el instante de tiempo t.
En general una onda puede tomar valores positivos y negativos. Una onda puede representarse por medio de una cantidad compleja.
Piense por ejemplo en el campo eléctrico de una onda electromagnética. Una probabilidad negativa, o compleja, es algo sin sentido. Esto significa que la función de onda no es algo observable. Sin embargo el módulo (o cuadrado) de la función de onda siempre es real y positivo. Por esto, se le conoce como la densidad de probabilidad.
La función de onda depende de los valores de tres (3) variables que reciben la denominación de números cuánticos. Cada conjunto de números cuánticos, definen una función específica para un electrón.
Para describir las características de un electrón situado en un determinado orbital, se necesitan cuatro números cuánticos, que se representan mediante las letras n, l, ml y ms. El significado físico de estos números, así como los valores que pueden tomar, se describen de la siguiente manera:
§ Número cuántico principal (n) Está relacionado con la energía del electrón. Si n aumenta, la distancia del electrón al núcleo y la energía que ésta partícula posee, también se incrementan. Los valores que puede tomar n están limitados a los números naturales: 1, 2, 3, etc.
§ Número cuántico secundario (l) Designa la forma del orbital. Los posibles valores de el dependen de n, de modo que, para cada valor de n, el número cuántico l puede tomar todos los valores comprendidos entre 0 y n – . Se acostumbra a simbolizar con letras los valores numéricos que puede tomar el número cuántico l, según:
Número cuántico secundario 0 1 2 3 4
Símbolo del orbital s p d f g
El número cuántico l también nos informa sobre la geometría que tiene el orbital. Un orbital s es un orbital esférico, un orbital p está formado por dos lóbulos; los orbitales d, f y g tienen formas más complejas.
§ Número cuántico magnético (ml) Está relacionado con la orientación del orbital en el espacio, o las orientaciones que presentan los orbitales de un mismo nivel. Para cada valor de l, el número cuántico m puede tomar todos los valores enteros comprendidos entre l y +l.
§ Número cuántico de espín (ms) Un orbital puede albergar como máximo dos electrones. Dichos electrones se diferencian entre sí por el sentido de giro sobre su eje. Cuando dos electrones ocupan el mismo orbital, sus sentidos de giro son opuestos. El número cuántico de espín corresponde al sentido de giro del electrón sobre su propio eje. Como sólo son posibles dos sentidos de giro, el número cuántico ms puede tomar solamente dos valores que son +1/2 y 1/2, que también se simbolizan con las flechas↑y↓, respectivamente.
El número cuántico de espín no se deriva de la ecuación de Schrödinger, sino que se introdujo para que la teoría fuera consistente con la experiencia. Como el electrón es una partícula cargada se comporta como un pequeño imán, por lo cual se dice que tiene un espín o giro.
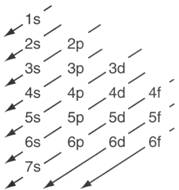
Configuraciones electrónicas.
Debido a la diferencia de carga entre el núcleo y los electrones se establece entre ambos una fuerza de atracción mutua. Además, como los electrones tienen la misma carga, tienden a repelerse entre sí. El equilibrio entre las fuerzas de atracción y repulsión hace que los electrones tengan determinadas posiciones en los diferentes niveles de energía.
La configuración electrónica de un átomo se puede deducir a partir de su espectro electromagnético.
Para determinar teóricamente cuál debe ser la configuración electrónica de un átomo, se utilizan los siguientes principios extraídos del modelo actual:
§ Principio de construcción. Al clasificar los elementos en orden creciente de números atómicos, cada átomo de un elemento tendrá un electrón más que el del elemento que le precede.
§ Principio de exclusión de Pauli. En un mismo átomo no pueden existir dos electrones que tengan los cuatro números cuánticos iguales; es decir, al menos uno de los cuatro números cuánticos debe ser distinto.
§ Principio de máxima multiplicidad de carga (regla de Hund). Cuando un orbital contiene únicamente un electrón, se dice que este electrón está desapareado. Los electrones que pertenecen a un mismo subnivel se disponen de manera que exista el mayor número posible de electrones desapareados con el mismo valor de espín.
Para establecer la posición en la cual se encuentran los electrones al interior de un átomo, se ha determinado que los niveles de energía están conformados de uno o más subniveles (s, p, d y f). Cada clase de subnivel posee una capacidad fija para alojar una cantidad determinada de electrones. Así, cualquier subnivel s puede contener hasta 2 electrones; el subnivel p, 6; el subnivel d, 10 y el subnivel f, 14. También se ha determinado que el subnivel s está formado por un solo orbital; el subnivel p por tres orbitales; el subnivel d comprende cinco orbitales y el f comprende siete orbitales.
Con el fin de distribuir los electrones dentro del átomo, se han establecido una serie de reglas básicas que responden a los principios de la teoría mecánico - cuántica y que permiten representar las configuraciones electrónicas de los átomos. Entendemos por configuración electrónica de un átomo, la distribución de los electrones en los diferentes orbitales atómicos.
Para encontrar la configuración electrónica de un átomo se deben seguir las reglas que se mencionan a continuación:
§ Los electrones se ubican en los orbitales de menor energía.
§ Cada electrón tiene sus propios números cuánticos (Pauli), o sea, que un orbital sólo puede contener máximo dos electrones con espines opuestos.
§ Cuando un subnivel tiene más de un orbital, los electrones van ocupando este subnivel, de forma que cada electrón adicional se ubica en orbitales diferentes con el mismo espín.
Cuadro de Aufbau.