Isomeria
1. O que � isomeria
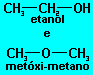
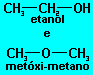
Isomeria � uma propriedade apresentada por dois ou mais compostos que possuem a mesma f�rmula molecular, mas diferentes estruturas, o que os tornam subst�ncias diferentes. Por exemplo, h� duas subst�ncias com a f�rmula molecular C2H6O:
| Isomeria � o fen�meno caracterizado pela exist�ncia de duas ou mais subst�ncias diferentes, que apresentam a mesma f�rmula molecular, mas diferentes f�rmulas estruturais. |
Esse fen�meno decorre do fato de que os diferentes elementos qu�micos podem ligar-se formando arranjos diferentes.
Podemos classificar a isomeria em plana ou espacial, e essa em geom�trica ou optica
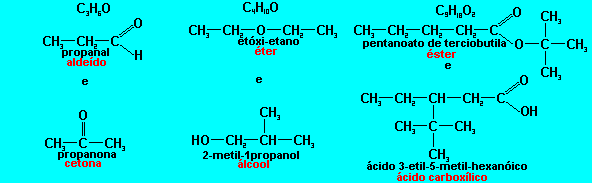
Na isomeria plana as subst�ncias t�m mesma f�rmula estrutural, mas f�rmulas estruturais planas diferentes. Existem cinco casos de isomeria plana: isomeria de fun��o, isomeria de cadeia ou n�cleo, isomeria de posi��o, isomeria de compensa��o ou metameria e isomeria din�mica ou tautomeria.
Os is�meros pertencem a fun��es diferentes. Geralmente ocorre isomeria de fun��o entre �lcool e �ter, �cido carbox�lico e �ster e entre alde�dos e cetonas.
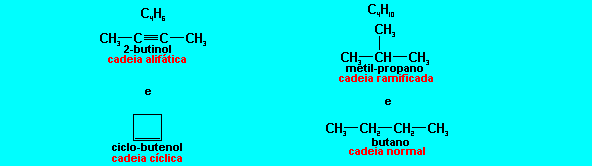
Isomeria de Cadeia ou de N�cleo
Os is�meros pertencem � mesma fun��o, mas apresentam diferentes tipos de cadeia.
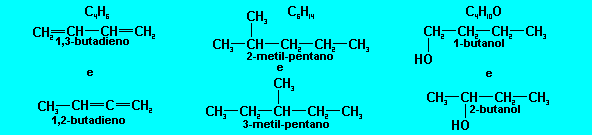
Os is�meros pertencem � mesma fun��o e apresentam o mesmo tipo de cadeia, mas apresentam diferen�a na posi��o de um grupo funcional, de uma ramifica��o ou de uma insatura��o.
Isomeria de Compensa��o ou Metameria
Os is�meros perten�em � mesma fun��o e apresentam o mesmo tipo de cadeia, mas apresentam diferen�a na posi��o de um hetero�tomo. A metameria pode ser considerada um caso particular da isomeria de posi��o.
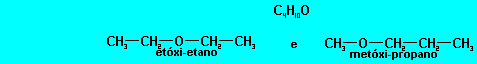
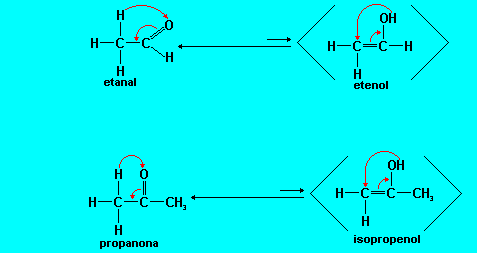
Isomeria Din�mica ou Tautomeria
Um caso particular de isomeria de fun��o, os is�meros coexistem em equil�brio din�mico em solu��o.Ocorre com compostos que apresentam o grupo carbonila.
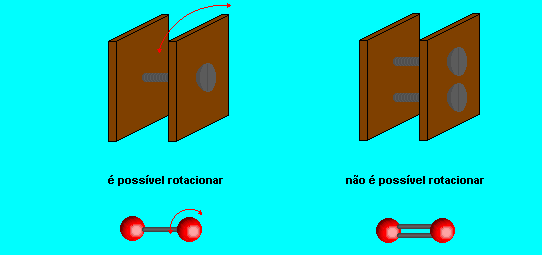
� um tipo de isomeria onde a difer�n�a entre os is�meros s� � percebida atrav�s da an�lise da f�rmula estrutural espacial. Existem dois tipos de isomeria espacial: geom�trica (cis-trans ou Z-E) e �ptica.
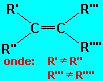
Esse tipo de isomeria espacial ocorre apenas quando h� compostos c�clicos ou compostos com uma dupla liga��o entre carbonos, cada um, radicais diferentes, de acordo com o esquema:
Isso n�o ocorre com liga��es simples porque seria poss�vel rotacionar a mol�cula.
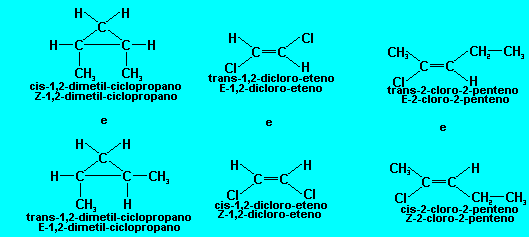
� importante notar que os compostos que apresentam isomeria geom�trica s�o subst�ncias diferentes e apresentam propriedades f�sicas diferentes:
| �cido mal�ico | �cido fum�rico | |
| PF (oC) | 130 | 287 |
| d (g/mL) | 1,590 | 1,635 |
| Solubilidade em �gua | sol�vel | pouco sol�vel |
| Constante de ioniza��o (K1) | 1,170 | 0,097 |
Para a nomenclatura dos compostos que apresentam isomeria acrescenta-se um prefixo, dependendo do caso:
| do latim | cis = pr�ximo a | trans = atrav�s de |
| do alem�o | Z: zusammen = juntos | E: entgegen = opostos |
Quando o composto apresentar, do mesmo lado do plano imagin�rio, os ligantes com maior n�mero de massa, ser� denominado cis ou Z. O outro composto ser� denominado tran ou E. Caso existam dois compostos de mesmo n�mero de massa, mas que sejam diferentes, como o n-propil e o isopropil, ligados no mesmo carbono, ser� considerado "com maior n�mero de massa", ou seja, ter� prioridade, aquele que for mais ramificado.
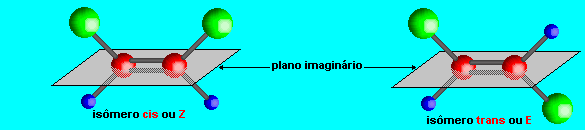
A luz � composta de ondas que vibram em diversos planos. Quando ela atravessa um polarizador a luz se transforma um luz polarizada que vibra em apenas um plano:

Existem algumas subst�ncias que tem a propriedade de desviar o plano de vibra��o da luz polarizada e s�o denominadas opticamente ativas. Tais compostos apresentem isomeria �ptica.
Um composto opticamente ativo pode desviar a luz polarizada em dois sentidos:
Os compostos que apresentam isomeria �ptica possuem pelo menos um carbono assim�trico ou quiral, ou seja, um carbono que apresente quatro ligantes diferentes. Os ligantes podem ser rotacionados, mas n�o � poss�vel uma perfeita sobreposi��o dos is�meros. Um dos is�meros � igual a imagem especular do outro.
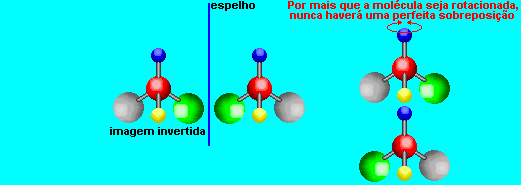
Uma amostra que contenha 50% de cada is�mero � chamada de mistura rac�mica. Com excess�o do sentido que os is�meros fazem a luz polarizada girar, eles apresentam propriedades f�sicas e qu�micas id�nticas, mas diferentes propriedades fisiol�gicas.
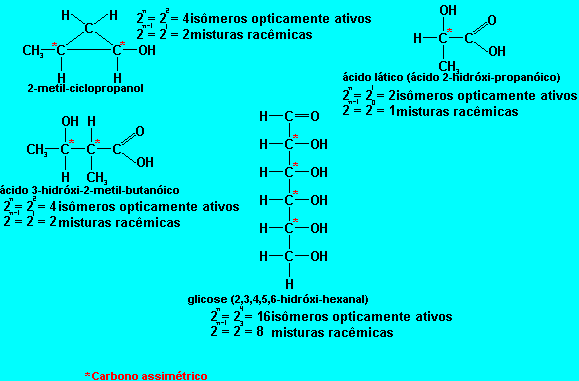
Uma mol�cula pode ter mais de um carbono quiral, portanto tal mol�cula teria mais de um par de is�meros opticamente ativos. Para calcular o n�mero de is�meros opticamente ativos em tal mol�cula utiliza-se a f�rmula 2n, onde n corresponde ao n�mero de carbonos assim�tricos. Podemos calcular tamb�m o n�mero de misturas rac�micas com a f�rmula 2n-1.
Compostos c�clicos tamb�m podem apresentar isomeria �ptica e as f�rmulas dos compostos alif�ticas tamb�m podem ser aplicadas.