

|
|
|
Introdução
Usamos o chamado efeito de capilaridade. Um tubo muito fino é chamado de tubo capilar por ser, possivelmente, tão fino quanto um fio de cabelo. Introduzindo um tubo capilar em um recipiente com água ela sobe pelas paredes do tubo até uma certa altura. Quem sustenta o peso da coluna de água no capilar é a tensão superficial. No caso, essa tensão se deve à interação entre as moléculas de água e a parede interna do capilar. Ao longo da circunferência de contato entre a água e a parede surgem forças atrativas que levantam a água até que são impedidas pelo peso da coluna. A resultante vertical dessa força é dada pelo produto da tensão superficial (em dinas/cm) pelo comprimento da circunferência interna do tubo (cm). O resultado é uma força que deve ser igual ao peso da coluna de água que subiu pelo tubo. Esse peso pode ser calculado medindo-se a altura da coluna desde o nível da água no recipiente até o menisco, que é a superfície abaulada no alto do tubo. O peso será o produto do volume da coluna pela densidade da água.
A tensão superficial da água é cerca de 0,075 N/m. A do álcool é 0,024 N/m. É mais difícil formar gotas de álcool que de água, nas mesmas condições.
Observe com cuidado os pontos onde a água encosta em um recipiente, na superfície livre do líquido. Você verá que se forma uma curvatura (menisco).
Quando um líquido está em contato com um sólido, as moléculas da superfície livre do líquido ficam sujeitas a duas forças: a coesão, dirigida para o interior da massa líquida, e a adesão, proporcionada pela atração das moléculas do sólido. Assim, as moléculas da superfície livre estão sujeitas à resultante dessas duas forças. Se a força de coesão for maior que de a força de adesão a superfície do líquido ficará côncava em relação ao capilar, caso contrário a superfície líquida ficará convexa.
No primeiro caso se diz que o líquido "molha" o sólido (isto é, adere ao sólido); no segundo caso "não molha".
Mergulhe uma lâmina de vidro em um líquido. O vidro atrai as moléculas da água e, na superfície livre, se forma um menisco côncavo. Assim, uma pequena camada de água é puxada para cima, junto à lâmina de vidro. Coloque outra lâmina, ao lado da primeira. As duas puxarão a água para cima e, então, uma camada maior de água se eleva ligeiramente no espaço entre as lâminas. Quanto mais estreito for esse espaço, mais alto se elevará a água.
Essa experiência explica porque os líquidos sobem em um tubo aberto, muito fino, embora a pressão externa e interna sejam a mesma. Isso acontece quando os tubos são "capilares" (isto é, de diâmetro interno muito pequeno) e o líquido molha o vidro. No caso do mercúrio, como as forças de coesão são superiores às de adesão, o líquido desce no tubo capilar. Em ambos os casos, o fenômeno é conhecido como capilaridade.
Em várias situações, o fenômeno da capilaridade desempenha um papel importante:
Em uma vela, é graças a capilaridade que a cera derretida sobe pelo pavio, para alimentar a chama.
Quando a extremidade de um pedaço de pano (ou papel) seco é introduzida na água, observa-se que o líquido atinge grande parte do tecido não mergulhado, porque é conduzido, por capilaridade, através das fibras do tecido.
Tensão superficial sobre um capilar:

Equações:
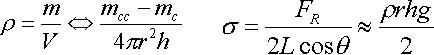
Experimento
Materiais utilizados
Becker com água e outro com álcool
Capilares (6)
Paquímetro para medir a altura da coluna de líquido (h)
Balança para obter o massa dos capilares
Picnômetro para medir a densidade da água e do álcool
Procedimentos
Meça a massa (mc) do capilar vazio;
Afunde-o no becker com o líquido;
Tire o capilar do líquido e deixe-o na vertical para escoar o excesso ;
Com o paquímetro meça a altura (h) da coluna de líquido preso no capilar ;
Meça novamente sua massa (mcc);
Repita estes procedimentos com os outros cinco capilares.
Resultados
|
Tabela 1 |
|||||
|
capilares |
mc (g) |
mcc (g) |
h (cm) |
r (cm) |
s |
|
c1 (água) |
|
|
|
|
|
|
c2 (água) |
|
|
|
|
|
|
c3 (água) |
|
|
|
|
|
|
c4 (álcool) |
|
|
|
|
|
|
c5 (álcool) |
|
|
|
|
|
|
c6 (álcool) |
|
|
|
|
|
|
rálcool |
Tálcool |
sm |
E% |
|
|
|
|
|
|
rágua |
Tágua |
sm |
E% |
|
|
|
|
|
Análise dos resultados
- Analize os resultados obtidos na tabela 1
Conclusão