|
Nanomagnetismo y cáncer A. González Arias
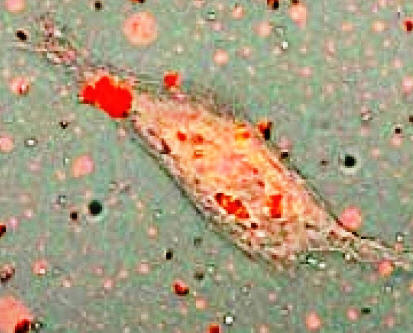
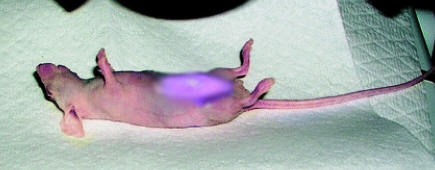
El inconveniente de la mayoría de las quimioterapias que combaten el cáncer es que son poco específicas. Al aplicar por vía intravenosa uno de estos productos, se dispersa en todo el organismo y ataca tanto al tumor como a las células sanas; aparecen así efectos secundarios indeseables, con perjuicio para el paciente. Es por eso que desde hace años se buscan vías alternativas para controlar la aplicación y el efecto de estos preparados con mayor precisión. Si fuera posible situar el medicamento sólo allí donde se le necesita, el remedio sería mucho más efectivo. Habría un menor peligro de dañar células sanas, y la cantidad de producto a utilizar se vería muy reducida, al igual que sus efectos secundarios. Las primeras ideas asociando las partículas magnéticas microscópicas y los tumores malignos no son recientes; fueron publicadas hace unos 40 años. Sin embargo, no fue hasta principios de siglo que en las revistas especializadas comenzaron a aparecer regularmente artículos relacionando la nanotecnología con el magnetismo, la bioquímica y el cáncer. Un artículo de revisión publicado en 2009 cuyo primer autor es Quentin Pankhurst, profesor del University College London y director del Davy-Faraday Research Laboratory, lista más de 110 artículos reportando estudios de nanomagnetismo aplicado a células y animales. Lo básico en estas investigaciones es buscar como enlazar de forma estable y biocompatible una nanopartícula magnética con algún fármaco citotóxico, que destruya las células cancerosas. Las micropartículas mixtas así obtenidas se agregan a un líquido adecuado para formar un ferrofluído con las partículas en suspensión. El fluido se introduce en el sistema circulatorio, y conjuntamente se aplica un campo magnético externo para atraer las partículas magnetizadas hacia la región del cuerpo donde se desea concentrar el citotóxico. La intensidad del campo aplicado debe variar con la distancia de forma apreciable, pues la fuerza magnética que actúa sobre las partículas no es proporcional a la intensidad del campo magnético, sino a su gradiente; es decir, a cuan rápido varía esa intensidad con la distancia. Una vez que el complejo fármaco-nanopartícula se concentra en el tumor, el medicamento se libera por algún procedimiento químico o físico, usualmente agregando otro fármaco que haga variar la actividad enzimática, la acidez del medio, o cambiando la temperatura del tumor. La figura muestra una célula cancerosa rodeada de pequeñas nanopartículas magnéticas mucho más oscuras, recubiertas de un péptido -molécula similar a una proteína- que tiene preferencia por algunos tipos de células de cáncer ovárico. Durante una investigación al efecto, realizada en 2008 en el Georgia Institute of Technology, se logró evaluar la biocompatibilidad añadiendo una sustancia fluorescente de color verde a células cancerosas. Esas células se introdujeron posteriormente en la cavidad abdominal de ratones de laboratorio, junto a partículas nanomagnéticas teñidas previamente de rojo. Al aplicar un campo magnético en el abdomen de los ratones apareció bajo la piel del vientre un área bien definida de resplandor verde-rojizo, indicando que las nanopartículas se habían enlazado a las células cancerosas, arrastrándolas hasta el imán. Existen muchos factores que influyen en el resultado final y por tanto deben ser estudiados en cualquier investigación. Entre estos se encuentran las características del flujo sanguíneo, la concentración de ferrofluído, el grosor de los tejidos, la distancia hasta el origen del campo magnético, la reversibilidad del enlace fármaco-nanopartícula y el volumen del tumor. Otras aplicaciones de las partículas nanomagnéticas son la de realzar las imágenes de Resonancia Magnética Nuclear y la de separar diferentes tipos de células en algunos estudios biológicos. Esta última técnica emplea nanopartículas sólo compatibles con el tipo de célula que se desea separar. Después que la partícula forma un vínculo estable con la entidad biológica deseada, la extracción se lleva a cabo en un medio líquido, haciendo pasar el fluido por algún dispositivo de separación magnética. Tal dispositivo puede ser algo tan sencillo como un tubo de ensayo al que se aplica un imán permanente en su exterior. Desde luego, también existen métodos mucho más sofisticados, que realizan la tarea con mayor eficiencia y rapidez. |
|