PROTEÍNAS
Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre; y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre entre otros elementos.
Pueden considerarse polímeros de unas pequeñas moléculas que reciben el nombre de aminoácidos, que son las unidades básicas de construcción de proteínas. Los aminoácidos están unidos mediante enlaces peptídicos.
La unión de un bajo número de aminoácidos da lugar a un péptido; si el número de aminoácidos que forma la molécula no es mayor de 10, se denomina oligopéptido, si es superior a 10 se llama polipéptido y si es superior a 50 aa. se habla ya de proteína.
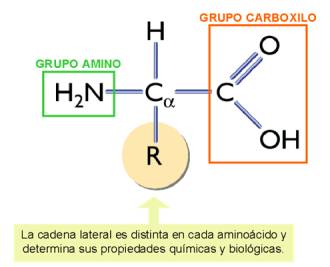
Los aminoácidos son las unidades básicas para formar las proteínas. Se caracterizan por poseer un grupo carboxilo (-COOH) y un grupo amino (-NH2).

Las otras dos valencias del carbono se saturan con un átomo de H y con un grupo variable denominado radical R.
Los radicales confieren al aminoácido unas características propias. Por ello, estos radicales se utilizan como criterio de clasificación de los aminoácidos.
Formando parte de las proteínas existen 20 aminoácidos. Existen otros aminoácidos, pero no se asocian formando macromoléculas.
Existen diferentes clasificaciones de los aminoácidos según la naturaleza del radical R. A continuación tenemos los aminoácidos clasificados en:
Aminoácidos hidrófobos: sus radicales son de naturaleza hidrocarbonada no polar; se encuentran en la parte más interna de las proteína solubles, ocultos del medio acuoso.
Aminoácidos polares hidrófilos: sus radicales son polares pero sin carga y pueden establecer puentes de hidrógeno con el agua, favoreciendo su solubilidad.
Aminoácidos básicos: sus radicales poseen un grupo amino que se ioniza positivamente.
Aminoácidos ácidos: sus radicales poseen un grupo carboxilo que se ioniza negativamente.
Aminoácidos
hidrófobos:
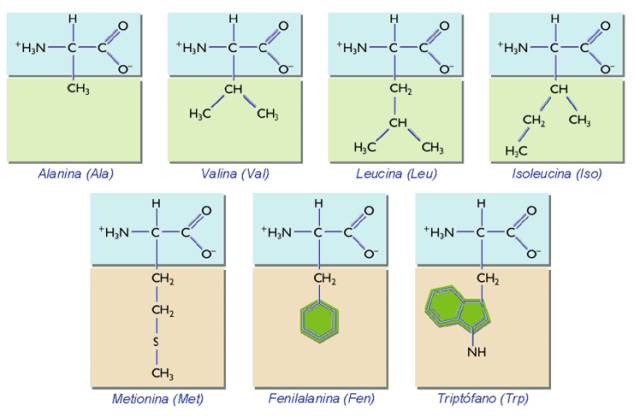
Aminoácidos
polares hidrófilos:
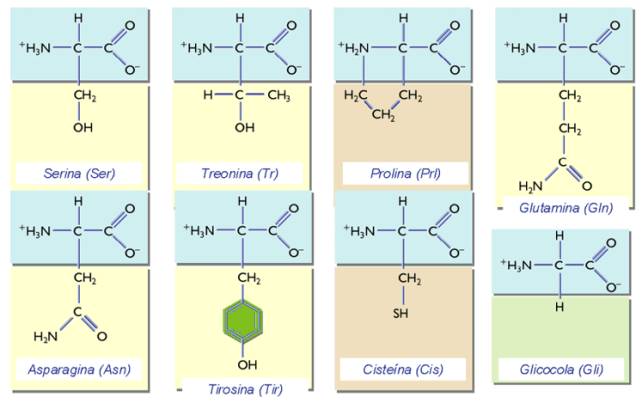
Aminoácidos
ácidos y básicos:
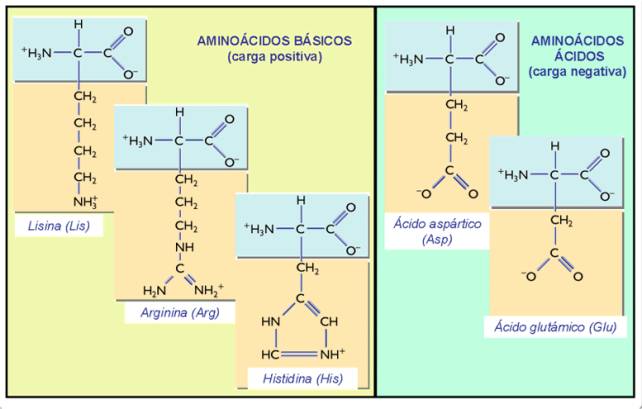
Los aminoácidos que un organismo no puede sintetizar y, por tanto, tienen que ser suministrados con la dieta se denominan aminoácidos esenciales; y aquellos que el organismo puede sintetizar se llaman aminoácidos no esenciales. Para la especie humana son esenciales ocho aminoácidos: treonina, metionina, lisina, valina, triptófano, leucina, isoleucina y fenilalanina (además puede añadirse la histidina como esencial durante el crecimiento, pero no para el adulto).
Los aminoácidos presentan isomería, ya que poseen un carbono asimético (carbono α), unido a cuatro radicales distintos (excepto en el caso de la glicina).
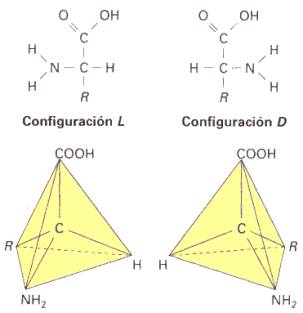
Existe
una forma D y otra forma L. Los isómeros de tipo D poseen, en
proyección lineal, el grupo amino (-NH2) hacia la derecha del
carbono asimétrico, mientras que los isómeros L presentan el grupo amino (-NH2)
a la izquierda del carbono asimétrico.
También existen isómeros ópticos. Las moléculas que desvían la luz polarizada a la derecha se denominan dextrógiras y se representan con el signo (+). Las moléculas que desvían la luz polarizada a la izquierda se denominan levógiras y se representan con el signo (-).
En disolución acuosa, los aminoácidos muestran un comportamiento anfótero: pueden ionizarse, según el pH, como un ácido, liberando protones y quedando como -COO- o como base, cuando los grupos -NH2 captan protones, quedando como -NH3+, o pueden aparecer como ácido y base a la vez. En este caso los aminoácidos se ionizan doblemente, apareciendo una forma dipolar iónica llamada zwitterion.
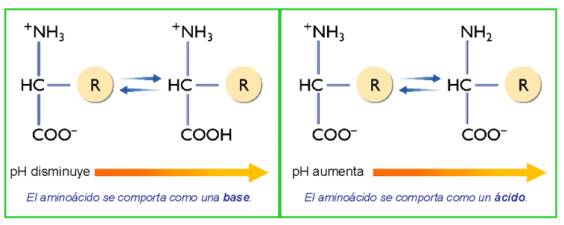
El punto isoeléctrico es el valor de pH al que el aminoácido presenta una carga neta igual al cero.
Los péptidos y proteínas están formados por la unión de aminoácidos mediante un enlace peptídico. Es un enlace covalente que se establece entre el grupo carboxilo de un aminoácido y el grupo amino del siguiente, dando lugar al desprendimiento de una molécula de agua.
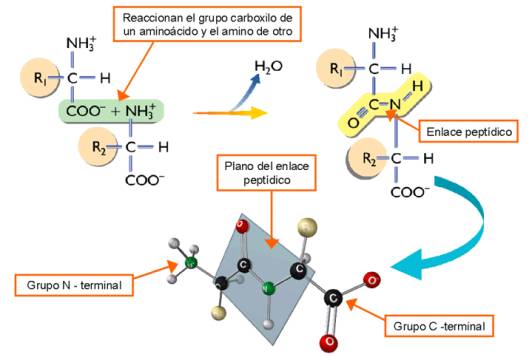
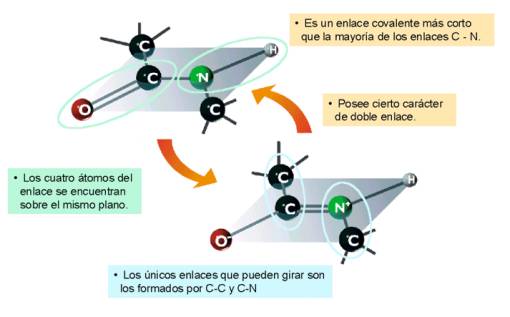
El enlace peptídico tiene un comportamiento similar al de un enlace doble, es decir, presenta una cierta rigidez que inmoviliza en un plano los átomos que lo forman.
La organización de una proteína viene definida por cuatro niveles estructurales de carácter jerarquizado denominados: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria. Cada una de estas estructuras informa de la disposición de la anterior en el espacio.
La estructura tridimensional de una proteína determina su funcionalidad.
La estructura primaria es la secuencia lineal de aminoácidos de la proteína. Nos indica qué aminoácidos componen la cadena polipeptídica y el orden en que dichos aminoácidos se encuentran. La función de una proteína depende de su secuencia y de la forma que ésta adopte.
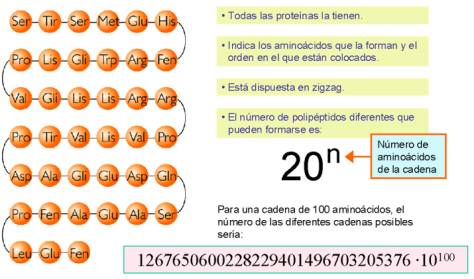
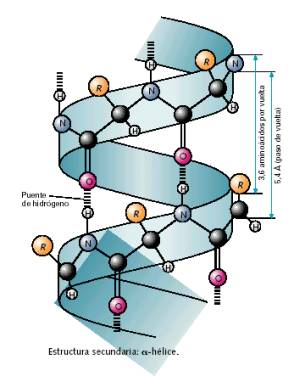
La estructura secundaria es la disposición de la secuencia de aminoácidos en el espacio. Los aminoácidos, a medida que van siendo enlazados durante la síntesis de proteínas y gracias a la capacidad de giro de sus enlaces, adquieren una disposición espacial estable, la estructura secundaria.
Existen dos tipos de estructura secundaria:
La hélice alfa.
La conformación
beta o lámina beta.

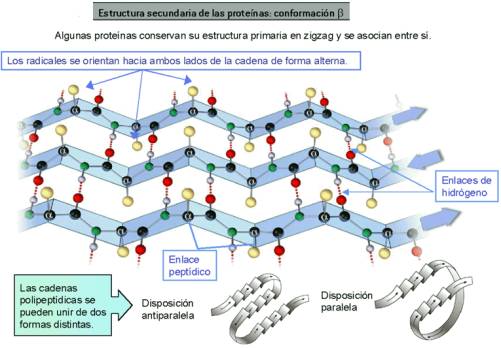
La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular compacta o una estructura fibrosa alargada.
En definitiva, es la estructura primaria la que determina cuál será la secundaria y por tanto la terciaria.
La conformación globular facilita la solubilidad en agua y así realizar funciones de transporte, enzimáticas, hormonales, etc.
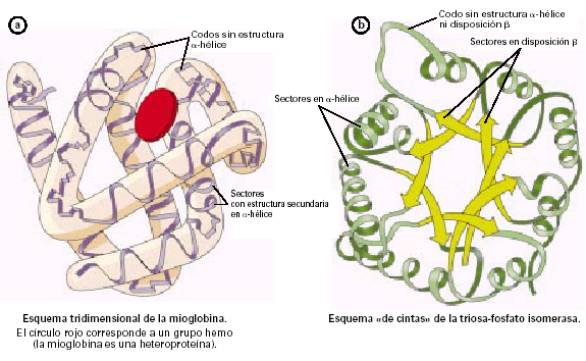
La estructura terciaria se mantiene estable gracias a la existencia de enlaces entre los radicales R de los aminoácidos. Aparecen varios tipos de enlaces:
Puentes disulfuro entre los radicales de aminoácidos que tiene azufre.
Puentes de hidrógeno.
Interacciones eléctricas.
Interacciones hidrofóbicas.
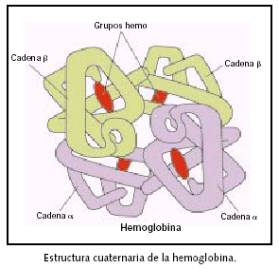 Esta
estructura informa de la unión, mediante enlaces débiles (no covalentes) de
varias cadenas polipeptídicas con estructura terciaria, para formar un complejo
proteico. Cada una de estas cadenas polipeptídicas recibe el nombre de protómero.
Esta
estructura informa de la unión, mediante enlaces débiles (no covalentes) de
varias cadenas polipeptídicas con estructura terciaria, para formar un complejo
proteico. Cada una de estas cadenas polipeptídicas recibe el nombre de protómero.
El número de protómeros varía desde dos como en la hexoquinasa,
cuatro como en la hemoglobina, o muchos como la cápsida del virus
de la poliomielitis, que consta de 60 unidades proteícas.
Solubilidad
Los
radicales de los aminoácidos permiten a las proteínas interaccionar con el
agua. Si abundan radicales hidrófobos, la proteína será poco o nada
soluble en agua. Si predominan los radicales hidrófilos, la proteína
será soluble en agua porque, al
ionizarse, establecen enlaces débiles (puentes de hidrógeno) con las moléculas
de agua. Así, cuando una proteina se solubiliza queda recubierta de una capa de
moléculas de agua (capa de solvatación) que impide que se pueda unir a otras
proteinas lo cual provocaría su precipitación (insolubilización). Esta
propiedad es la que hace posible la hidratación de los tejidos de los seres
vivos.
Especificidad
La especificidad se puede referir a su función: cada proteína lleva a
cabo una determinada función y la realiza porque posee una determinada
estructura primaria y una conformación espacial propia; por lo que un
cambio en la estructura de la proteína puede significar una pérdida de la
función.
También se puede hablar de especificidad de especie: no todas las proteinas son iguales en todos los organismos, cada individuo posee proteínas específicas propias que se ponen de manifiesto en los procesos de rechazo de órganos transplantados.
La semejanza entre proteínas son un grado de parentesco entre individuos, por lo que sirve para la construcción de árboles filogenéticos.
Desnaturalización
 Consiste
en la pérdida de la estructura terciaria, por romperse los puentes que forman
dicha estructura. Todas las proteínas desnaturalizadas tienen la misma
conformación, muy abierta y con una interacción máxima con el disolvente, por
lo que una proteína soluble en agua cuando se desnaturaliza se hace insoluble
en agua y precipita.
Consiste
en la pérdida de la estructura terciaria, por romperse los puentes que forman
dicha estructura. Todas las proteínas desnaturalizadas tienen la misma
conformación, muy abierta y con una interacción máxima con el disolvente, por
lo que una proteína soluble en agua cuando se desnaturaliza se hace insoluble
en agua y precipita.
La desnaturalización se puede producir por cambios de temperatura, (huevo cocido o frito) o por variaciones del pH (rizos de la permanente).
El cambio de pH produce cambios en las interacciones electrostáticas entre las cargas de los radicales de los aminoácidos. La modificación de la temperatura puede romper puentes de hidrógeno o facilitar su formación.
En algunos casos, si las condiciones se restablecen, una proteína desnaturalizada puede volver a su anterior plegamiento o conformación, proceso que se denomina renaturalización.
Capacidad amortiguadora
Las proteinas tienen un comportamiento anfótero y esto las hace capaces de neutralizar las variaciones de pH del medio, ya que pueden comportarse como un ácido o una base y, por tanto, liberar o retirar protones (H+) del medio donde se encuentran.
Las
proteínas se clasifican en:
HOLOPROTEÍNAS
Formadas solamente por aminoácidos.
Pueden ser globulares o fibrosas.
HETEROPROTEÍNAS
Formadas por una fracción proteínica y por un grupo no proteínico, que se denomina grupo prostético.
Existen diferentes tipos según ese grupo prostético: glucoproteínas, lipoproteínas, nucleoproteínas, cromoproteínas...
HOLOPROTEÍNAS |
|
Globulares |
|
Fibrosas |
|
HETEROPROTEÍNAS |
|
Glucoproteínas |
|
|
Lipoproteínas
|
|
|
Nucleoproteínas
|
|
|
Cromoproteínas
|
|
Estructural |
|
|
Enzimatica
|
|
|
Contráctil |
|
|
Hormonal
|
|
|
Defensiva |
|
Homeostática
|
|
|
Transporte |
|
|
Reserva
energética |
|