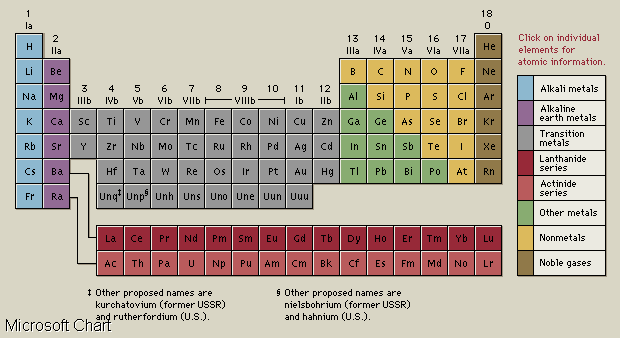
Historia de la Tabla Periódica
La Ley Periódica, en la química, la ley establece que muchas de las propiedades físicas y químicas de los elementos tienden a recurrir de una manera sistemática con el número atómico creciente. Progresar desde los átomos más livianos a los átomos más pesados, ciertas propiedades de los elementos aproximadamente las intervalos regulares de 2, 8,18, y 32. Por ejemplo, el segundo elemento (helio) es similar en su comportamiento químico al décimo (neón), así como también al 18º (argón), el 36º ( criptón), el 54º (xenón) y el 86º (radón). La familia química llamó a los halógenos, a los compuestos del elemento 9 (flúor),
17 (cloro), 35 (bromo), 53 (yodo) y 85 (astatinae), es una familia sumamente reactiva.

-El Desarrollo Histórico
Como resultado de descubrimientos que firmemente establecieron la teoría atómica de la materia en el primer cuarto del siglo XIX, los científicos podían determinar los pesos relativos de los átomos de los elementos entonces conocidos.
El desarrollo de la electroquímica durante este período por los químicos ingléses Humphry Davy y Miguel Faraday condujeron al descubrimiento de muchos elementos adicionales. Por 1829 un número suficiente de elementos se había descubierto para permitir que el químico alemán Johann Wolfgang Döbereiner observara que ciertos elementos con propiedades estrechamente similares ocurren en ternos, o grupos de tres, tal como cloro, bromo, y yodo; el calcio, estronio, y bario; el sulfuro, selenio, y telurio. A causa del número limitado de elementos conocidos y la turbación que existió en lo que concierne a la distinción entre pesos atómicos y pesos moleculares, sin embargo, los químicos eran incapaces de asir la importancia de los ternos de Döbereiner.
El desarrollo del espectroscopio en 1859 por los físicos alemanes Robert Wilhelm Bunsen y Gustav Robert Kirchhoff hizo posible el descubrimiento de otros muchos elementos. En 1860, en el primer congreso químico internacional que hubo, el químico italiano Stanislao Cannizzaro aclaró el hecho de que algunos de los elementos - por ejemplo, el oxígeno - tiene moléculas que contienen dos átomos. Esta realización le permitio a los químicos finalmente lograr un listado consistente y propio de los elementos.
Estos desarrollos dieron ímpetu nuevo al intento de dar a conocer interrelaciones entre las propiedades de los elementos. En 1864 el químico Británico John A. R. Newlands enumeró los elementos en orden de acuerdo a los pesos atómicos crecientes y anoto que un conjunto determinado de
propiedades ocurre en cada octavo lugar. El nombró a esta repetición periódica la ley de octavas, por la analogía con las escalas musicales. El descubrimiento de Newlands fracaso en el intento de impresionar sus contemporáneos, probablemente porque la periodicidad observadada se limitó a solo a un número pequeño de los elementos conocidos.
Mendeleyev y Meyer
La ley química que dice que las propiedades de todos los elementos sonlas funciones periódicas de sus pesos atómicos se desarrolló
independientemente por dos químicos, en 1869 por el ruso Dmitry
Mendeleyev y en 1870 por el alemán Julius Lothar Meyer. La llave al éxito de sus esfuerzos era la realización de los intentos previos habían fracasado porque un número de elementos no habían sido descubiertos hasta ahora y que los lugares vacantes deben dejarse para tales elementos en la clasificación. Así, aunque ninguno de los elementos conocidos en ese entonces tenia un peso atómico entre los del calcio y titanio, Mendeleyev dejo un espacio vacante para eso en su mesa. Este lugar se asignó luego al elemento escandio, descubierto en 1879, que tiene propiedades que han justificado su posición en la sucesión. El descubrimiento del escandio fue el resultado de una serie de constataciones dramáticas de los prognósticos con
base en la ley periódica, y la validación de la ley aceleró el desarrollo de la química mineral.
La ley periódica ha experimentado dos elaboraciones principales desde su formulación original por Mendeleyev y Meyer. La primera enmienda
involucra la extención de la ley para incluir una familia nueva entera de elementos, la existencia de que era completamente inesperada en el siglo XIX. Este grupo comprendió los primeros tres de los gases nobles o inertes, argon, helio y neón, descubiertos en la atmósfera entre 1894 y 1898 por el físico inglés John William Strutt, 3er Barón Rayleigh y el químico inglés William Ramsay. El segundo desarrollo en la ley periódica era la interpretación de la causa de la periodicidad de los elementos desde el punto de vista de la teoría de Böhr (1913) de la estructura electrónica del átomo.